ثنايي قطب
Dipolar - Dipolaire
ثنائي القطب
ثنائي القطب dipole هو جملة مؤلفة من شحنتين متساويتين ومتعاكستين (إحداهما موجبة والأخرى سالبة)، تفصل بينهما مسافة ضئيلة جداً. ويدل جداء إحدى الشحنتين في المسافة الفاصلة بينهما على عزم ثنائي القطب، وهو متجه يتجه من مركز الشحنة السالبة إلى مركز الشحنة الموجبة باصطلاح الفيزيائيين، وبالاتجاه المعاكس باصطلاح الكيميائيين.
ويكون عزم ثنائي القطب لشحنتين عنصريتين e+ وe- موجودتين على بعد أنغستروم واحد، مساوياً وحدة سغثية كهربائية ساكنة (4.803 ×10-10 ×10-8 » 4.8× 10-18) وذلك في حالة الشحنة العنصرية أي: e = ك1.6 ´10-19كولون، أو تساوي 4.803×10-10 وحدة كهربائية ساكنة في الجملة السغثية حيث كل وحدة سغثية تساوي 0.334×10 9 كولون.
ويستخدم عادة الحرف D (الحرف الأول من اسم العالم ديباي Debye) وحدة قياس لهذا العزم، والديباي الواحد يساوي 10-18 وحدة سغثية لكل سنتمتر، أي إنه يوافق شحنتين عنصريتين تبعد إحداهما عن الأخرى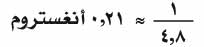 أنغستروم.
أنغستروم.
ولدراسة عزم ثنائي القطب أهميةً بالغة، لأنها تقدم معلومات قيِّمة عن طبيعة الرابطة بين الجزيئات من جهة، وعن بنيتها من جهة أخرى؛ وهكذا فإن مقارنة عزم ثنائي القطب النظري عز مع عزم ثنائي القطب التجريبي عزَ للجزيء أ - ب، تبين نصيب الجزيء من الرابطة. فيمكن على سبيل المثال حساب عز للجزيء H-Cl (على فرض أنه من النوع الشاردي -He+ -Cle من العلاقة عز= 10-8 ×1.27×10-10×4.8=6.1 حيث المسافة الفاصلة بين الشحنتين هي 1.27 أنغستروم، أما قيمة عزم ثنائي القطب عزَ التجريبية فهي نحو 1.03 ديباي. فالنسبة بينهما هي تقريباً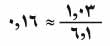 ، فيقال بأن الجزيء H-Cl ليس شاردياً تماماً، ولكنه يتمتع بنصيب من الرابطة الشاردية مقداره 16%، ويتمتع بنصيب من الرابطة المشتركة مقداره 84%، وهذا يعني أن إلكترونات الرابطة لا تنتقل إلا قليلاً نحو ذرة الكلور، ويمكن تعميم ذلك على معظم هاليدات الهدروجين.
، فيقال بأن الجزيء H-Cl ليس شاردياً تماماً، ولكنه يتمتع بنصيب من الرابطة الشاردية مقداره 16%، ويتمتع بنصيب من الرابطة المشتركة مقداره 84%، وهذا يعني أن إلكترونات الرابطة لا تنتقل إلا قليلاً نحو ذرة الكلور، ويمكن تعميم ذلك على معظم هاليدات الهدروجين.
وتبين دراسة عزم ثنائي القطب كذلك البنية الفراغية للجزيئات. فإذا كان عزم ثنائي القطب كميةً متجهة فهو يساوي المجموع الاتجاهي لعزوم ثنائيات القطب لروابط المركب، ومن ثم يمكن حساب الزوايا بين الروابط في المركب من قياس محصلة العزوم ثم مقارنتها مع المجموع الاتجاهي لعزوم الروابط في الصيغ النظرية، فالجزيئات في المعقدات من الصيغة MA2 إما أن تكون خطية بعزم ثنائي قطب معدوم، وإمّا زاويةً بقيمة محدودة.
فالجزيئات الخطية من الصيغة CO2 وBeCl2 وغيرها تتمتع بعزوم ثنائيات قطب معدومة، أما الجزيئات H2O وSO2 وNO2 وغيرها فهي ليست خطية، وإنما زاويَّة لأنها تتمتع بعزوم ثنائيات أقطاب محددة.
ويساعد عزم ثنائي القطب أيضاً على التمييز بين المتماكبات، إذ إن قيمة عزم ثنائي القطب تختلف باختلاف نوع المتماكب في المعقدات. فالمعقد المستوي من الصيغة Ma2b2 يتمتع بمتماكبين أحدهما مقرون، والآخر مفروق، إذ تنعدم قيمة العزم في الشكل المفروق، في حين تكون كبيرة في الشكل المقرون.
وفي المركبات العضوية تكون الذرات أو الجذور F سالبة مثل --O و-NO و-NO2 و-Cl في حين تكون الجذور الكربونية موجبة، وهذا ما يفسر كبر عزم ثنائي القطب للمركبات CH3Cl، C2H5OH، C6H5NO2، C6H5Cl، ... . ويترجم هذا بثوابت عازلية كهربائية كبيرة في الحالة السائلة.
عبد المجيد البلخي
Dipolar - Dipolaire
ثنائي القطب
ثنائي القطب dipole هو جملة مؤلفة من شحنتين متساويتين ومتعاكستين (إحداهما موجبة والأخرى سالبة)، تفصل بينهما مسافة ضئيلة جداً. ويدل جداء إحدى الشحنتين في المسافة الفاصلة بينهما على عزم ثنائي القطب، وهو متجه يتجه من مركز الشحنة السالبة إلى مركز الشحنة الموجبة باصطلاح الفيزيائيين، وبالاتجاه المعاكس باصطلاح الكيميائيين.
ويكون عزم ثنائي القطب لشحنتين عنصريتين e+ وe- موجودتين على بعد أنغستروم واحد، مساوياً وحدة سغثية كهربائية ساكنة (4.803 ×10-10 ×10-8 » 4.8× 10-18) وذلك في حالة الشحنة العنصرية أي: e = ك1.6 ´10-19كولون، أو تساوي 4.803×10-10 وحدة كهربائية ساكنة في الجملة السغثية حيث كل وحدة سغثية تساوي 0.334×10 9 كولون.
ويستخدم عادة الحرف D (الحرف الأول من اسم العالم ديباي Debye) وحدة قياس لهذا العزم، والديباي الواحد يساوي 10-18 وحدة سغثية لكل سنتمتر، أي إنه يوافق شحنتين عنصريتين تبعد إحداهما عن الأخرى
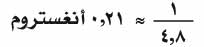 أنغستروم.
أنغستروم.ولدراسة عزم ثنائي القطب أهميةً بالغة، لأنها تقدم معلومات قيِّمة عن طبيعة الرابطة بين الجزيئات من جهة، وعن بنيتها من جهة أخرى؛ وهكذا فإن مقارنة عزم ثنائي القطب النظري عز مع عزم ثنائي القطب التجريبي عزَ للجزيء أ - ب، تبين نصيب الجزيء من الرابطة. فيمكن على سبيل المثال حساب عز للجزيء H-Cl (على فرض أنه من النوع الشاردي -He+ -Cle من العلاقة عز= 10-8 ×1.27×10-10×4.8=6.1 حيث المسافة الفاصلة بين الشحنتين هي 1.27 أنغستروم، أما قيمة عزم ثنائي القطب عزَ التجريبية فهي نحو 1.03 ديباي. فالنسبة بينهما هي تقريباً
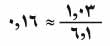 ، فيقال بأن الجزيء H-Cl ليس شاردياً تماماً، ولكنه يتمتع بنصيب من الرابطة الشاردية مقداره 16%، ويتمتع بنصيب من الرابطة المشتركة مقداره 84%، وهذا يعني أن إلكترونات الرابطة لا تنتقل إلا قليلاً نحو ذرة الكلور، ويمكن تعميم ذلك على معظم هاليدات الهدروجين.
، فيقال بأن الجزيء H-Cl ليس شاردياً تماماً، ولكنه يتمتع بنصيب من الرابطة الشاردية مقداره 16%، ويتمتع بنصيب من الرابطة المشتركة مقداره 84%، وهذا يعني أن إلكترونات الرابطة لا تنتقل إلا قليلاً نحو ذرة الكلور، ويمكن تعميم ذلك على معظم هاليدات الهدروجين.وتبين دراسة عزم ثنائي القطب كذلك البنية الفراغية للجزيئات. فإذا كان عزم ثنائي القطب كميةً متجهة فهو يساوي المجموع الاتجاهي لعزوم ثنائيات القطب لروابط المركب، ومن ثم يمكن حساب الزوايا بين الروابط في المركب من قياس محصلة العزوم ثم مقارنتها مع المجموع الاتجاهي لعزوم الروابط في الصيغ النظرية، فالجزيئات في المعقدات من الصيغة MA2 إما أن تكون خطية بعزم ثنائي قطب معدوم، وإمّا زاويةً بقيمة محدودة.
فالجزيئات الخطية من الصيغة CO2 وBeCl2 وغيرها تتمتع بعزوم ثنائيات قطب معدومة، أما الجزيئات H2O وSO2 وNO2 وغيرها فهي ليست خطية، وإنما زاويَّة لأنها تتمتع بعزوم ثنائيات أقطاب محددة.
ويساعد عزم ثنائي القطب أيضاً على التمييز بين المتماكبات، إذ إن قيمة عزم ثنائي القطب تختلف باختلاف نوع المتماكب في المعقدات. فالمعقد المستوي من الصيغة Ma2b2 يتمتع بمتماكبين أحدهما مقرون، والآخر مفروق، إذ تنعدم قيمة العزم في الشكل المفروق، في حين تكون كبيرة في الشكل المقرون.
وفي المركبات العضوية تكون الذرات أو الجذور F سالبة مثل --O و-NO و-NO2 و-Cl في حين تكون الجذور الكربونية موجبة، وهذا ما يفسر كبر عزم ثنائي القطب للمركبات CH3Cl، C2H5OH، C6H5NO2، C6H5Cl، ... . ويترجم هذا بثوابت عازلية كهربائية كبيرة في الحالة السائلة.
عبد المجيد البلخي
