لامعدن
Nonmetal - Non-métal
اللامعدن
معظم عناصر الجدول الدوري[ر] معادن metals. أما عدد اللامعادن nonmetals فلا يتجاوز العشرين. وتوجد المعادن في الجدول الدوري إلى يسار الخط المنكسر (الشكل-1)، واللامعادن إلى يمين ذلك الخط.
قلَّما يصادف عنصر يتمتع بجميع خواص المعادن أو اللامعادن، فالعناصر كافة تقريباً تجمع بين خواص المعادن واللامعادن بنسب متفاوتة. وتقع المعادن النموذجية في القسم الأيسر والسفلي من الجدول الدوري، في حين تحتل اللامعادن النموذجية القسم الأيمن العلوي فيه. أما العناصر التي تمتد بين هذين القسمين فهي عناصر وسطية، إلا أنه ليس هناك حدود واضحة تفصل بين هذه المناطق الثلاث. فالهدروجين، على سبيل المثال، يصنَّف لامعدناً، إذا اعتبرت حالته الغازية ووزنه النوعي وتحوّله إلى شوارد سالبة في الهدريدات. إلا أنه يمكن تصنيفه معدناً بالنظر إلى ناقليته الجيدة للحرارة وتشكيله أيونات موجبة في محاليل الحموض. والأنتموان Sb صلب في الدرجة العادية من الحرارة، ويتمتع ببريق معدني إلا أنه هش لا يقبل الطرق والسحب، ويكوّن مع الهدروجين، مثل اللامعادن، مركباً طياراً ذا صيغة محددة SbH3.
والعناصر الوسطية، القريبة من الخط المنكسر بخاصة، تتمتع بخواص المعادن واللامعادن في الوقت نفسه، ويطلق على هذه العناصر اسم أشباه المعادن metalloids وهي: البور B، السيلكون Si، الجرمانيوم Ge، الزرنيخ As، التلوريوم Te. وأشباه المعادن تشبه، نوعاً ما، اللامعادن في خواصها الفيزيائية والكيمياوية.
لعل من الأفضل بدلاً من تقسيم العناصر إلى معادن ولامعادن شرح الخواص المعدنية[ر:المعدن] والخواص اللامعدنية. فإذا أمكن إهمال الخواص اللامعدنية مقابل الخواص المعدنية، عدّ العنصر معدناً نموذجياً، وبالعكس. فمن المعادن النموذجية المعادن القلوية مثل الصوديوم والبوتاسيوم على الرغم من وزنها النوعي المنخفض نسبياً، ومن اللامعادن الكربون على الرغم من ناقليته الجيدة للكهرباء وارتفاع درجة انصهاره.
الخواص الفيزيائية للامعادن النموذجية
إن ما يميز الحالة المعدنية من اللامعدنية هو طبيعة الرابطة وشكل البنية البلورية، أما جميع الخواص الأخرى الملازمة للحالة المعدنية كالبريق المعدني والخواص الحرارية والكهربائية واللدونة فهي نتائج لطبيعة الرابطة المعدنية والبنية البلورية المعدنية.
اللامعادن، من حيث المظهر، غازات أو أجسام صلبة درجات انصهارها منخفضة، مثال ذلك الهالوجينات، وهي عناصر الفصيلة VII A التي تعدّ لامعادن نموذجية. فالفلور F2 والكلور Cl2 غازان، البروم Br2 سائل، واليودI2 صلب درجة انصهاره 113.75 ْس.
تتفق الرابطة المشتركة المميزة للاّمعادن مع الرابطة المعدنية من حيث الطبيعة إذ إن كلاً من الرابطتين يتولّد من اشتراك الذرات فيما بينها بإلكترونات التكافؤ، إلا أن الرابطة المشتركة رابطة متموضعة localized، تنشأ بين ذرتين متجاورتين وتبقى الإلكترونات المشتركة في جوارهما المباشر، مرتبطة بهما ارتباطاً متيناً، وهذه الرابطة المتينة بين ذرات الجسم الصلب لا تسمح بانزلاق الذرات بعضها حول بعض من دون تفكك الرابطة وتخرب بنيان هذا الجسم. وهذا ما يفسر كون البلورات الملحية واللامعادن الصلبة ذات الروابط المشتركة هشة وقابلة للكسر، بخلاف المعادن التي تتمتع بلدونة كبيرة بفضل الرابطة المعدنية[ر:الرابطة الكيمياوية].
اللامعادن، بخلاف المعادن، ليست لدنة لأن الرابطة المشتركة فيها لا تتحرك بتحرك إلكترونات التكافؤ، لذلك لا يمكن لذراتها أن تتحرك بالنسبة لبعضها بعضاً من دون أن تؤدي الحركة إلى انفصام الرابطة المشتركة وتصدُّع البنيان اللامعدني، فهي لذلك لا تقبل السحب والطَرْق والمعالجات الميكانيكية الأخرى سواء بالطريقة الباردة أو بالطريقة الساخنة.
اللامعادن، بخلاف المعادن، رديئة النقل للحرارة والكهرباء، ويعود السبب في ذلك إلى طبيعة الرابطة فيها، إذ تعلّل الناقلية الحرارية في النظريات التقليدية بسرعة تحرك الإلكترونات واصطدامها بعضها ببعض اصطداماً مرناً، وهذا التحرك السريع غير ممكن في اللامعادن. أما الناقلية الكهربائية فتنشأ من سهولة تحرك الإلكترونات في حقل كهربائي مؤثر في المادة، حتى لو كان هذا الحقل ضعيفاً، فالإلكترونات تتحرك من دون انتظام في كتلة المعدن في حال غياب الحقل الكهربائي، أما عند تطبيق فرق كمون معين بين طرفي قطعة معدنية، فإنه ينشأ حقل كهربائي ينظم حركة الإلكترونات باتجاه القطب الموجب مما، يولِّد التيار الكهربائي.
وتعلَّل الناقلية الحرارية والكهربائية العالية في المعادن وانخفاضها في أشباه المعادن واللامعادن حسب النظريات الحديثة، بأن حالة الإلكترونات الخارجية في الذرة الحرة لعنصر تختلف عن حالتها عندما تجتمع ذرات العنصر لتكوّن كتلة متراصَّة، في حين تحافظ الإلكترونات الداخلية على حالتها الطاقية، ففي الذرات الحرة تكون الإلكترونات الخارجية (إلكترونات التكافؤ) ذات طاقات محدّدة، أو بتعبير آخر، تشغل سويات طاقة محددة. أما في كتلة العنصر، عندما تصبح هذه الإلكترونات خاضعة لتأثير عدد كبير من النوى، فإن السويات الطاقية الممكنة لهذه الإلكترونات تزداد حتى قيم أعلى، أو بتعبير آخر، تشغل هذه الإلكترونات منطقة طاقية عريضة محددة أعلى من سويات الطاقة الموافقة في الذرات الحرة، وبالتالي تصبح الطاقة اللازمة لإثارة الإلكترون الخارجي كي ينتقل إلى حالة طاقية أعلى أو لخروجه من الغلاف الإلكتروني أصغر بكثير، ويكفي لذلك حقل كهربائي صغير أو طاقة حرارية صغيرة. ويبقى مبدأ باولي[ر: الذرة] مطبقاً على توزيع الإلكترونات في المناطق الطاقية، كما في حالة الذرات الحرة. وإذا كانت المناطق الطاقية الممكنة مشغولة بصورة تامة فإن الانتقال من حالة إلى أخرى يصبح غير ممكن، وتكون الناقلية الكهربائية والحرارية معدومة (كما في حالة اللامعادن)، وكلما كان الفرق بين سويتي الطاقة الموافقتين للحالة العادية والحالة المثارة صغيراً (في حالة وجود مناطق طاقية شاغرة) كانت الناقلية الحرارية والكهربائية أجود.
وعلى هذا فإن ما يميز المعدن من اللامعدن هو أن المعدن يحوي سويات طاقية إلكترونية شاغرة وسويات طاقية تشغلها الإلكترونات المثارة بامتصاص طاقة صغيرة نسبياً، في حين لا توجد في كتلة اللامعدن النموذجي (أو في المواد العازلة) سويات طاقة شاغرة. وتكون السويات المثارة الممكنة عالية لايمكن بلوغها إلا بامتصاص طاقة كبيرة، فاللامعدن لا يصبح ناقلاً إلا في درجات الحرارة العالية.
أشباه المعادن تنقل التيار الكهربائي، ولكن ليس بجودة المعادن، فمعظمها أنصاف نواقل[ر]. وللسيلسيوم[ر] Si والجرمانيوم[ر] Ge، خاصة، تطبيقات واسعة لكونهما أنصاف نواقل. تكون أبخرة المعادن النموذجية غالباً في الحالة الذرية بخلاف اللامعادن التي تكون في الحالة الغازية متعددة الذرات (باستثناء الغازات الخاملة أحادية الذرة).
الخواص الكيمياوية للامعادن النموذجية
إن ما يميز اللامعادن من الوجهة الكيماوية، هو ميل ذراتها إلى ضم إلكترون أو عدة إلكترونات متحولة إلى شوارد (أيونات) سالبة، كما في الأملاح. ولهذا كانت قيم كمونات تشردها ionization potential كبيرة (وكمون التشرد هو الطاقة اللازمة لنزع أضعف الإلكترونات ارتباطاً بالذرة وهي بالحالة الغازية وتحولها إلى شاردة موجبة وهي بالحالة الغازية). فكمون تشرد الذرة، مقدراً بالكيلوجول/مول، للآزوت (لامعدن) 1402، وللصوديوم (معدن نشيط)496، وللكلسيوم (معدن أقل فعالية من الصوديوم) 599، وللزرنيخ 947.
يتحدد ميل الذرة لضم الإلكترونات، كمياً، بقيمة كمون المسرى النظامي normal electrode potential الموافقة لها (بالفولط)، وتنظَّم هذه القيم في جدول، هو الجدول الكهرحركي[ر. الكيمياء الكهربائية]. فكمون مسرى السيزيوم (معدن) Cs+/Cs يساوي -2.923 فولط وكمون مسرى الصوديوم الأقل فعالية من السيزيوم Na+/Na-2.71 فولط، وكمون مسرى الفلور 2F-/F2 يساوي +2.87 فولط وكمون مسرى الهدروجين 2H+/H2 يساوي الصفر. فالمعادن الفعالة تقع فوق الهدروجين بالجدول الكهرحركي، ولها قيم كمون مسرى سالبة. والعناصر التي تقع تحت الهدروجين بالجدول الكهرحركي أقل كهرجابية من الهدروجين، ولها قيم كمون مسرى موجبة.
لايقل جدول الكهرسلبية electronegativity أهمية عن الجدول الكهرحركي، إذ يمكن بالاستناد إليه تعيين طبيعة الرابطة بين ذرتين في مركَّب. والكهرسلبية هي ميل الذرة لجذب إلكترونات نحوها في الجزيء المعتدل، فالكلور، على سبيل المثال، أكثر كهرسلبية من الهدروجين، وهذا يعني أن الزوج الإلكتروني بين H وCl في المركَّب HCl، هذا الزوج يمضي وقتاً أطول حول الذرة الأكثر كهرسلبية، مما يكسب الكلور في الجزيء شحنة سلبية جزئية(δ-) ، ويكون الجزيء قطبياً أي إن له قطبين الهدروجين شحنته (δ-) والكلور شحنته (δ-)[ر: ثنائي القطب]. وقد وضع الأميركي بولنغ Pauling مقياساً كمياً لميل الذرات لضم الإلكترونات لها، ورتب القيم في جدول (الجدول-1). فأشد العناصر كهرسلبية الفلور كهرسلبيته تساوي 4.0 وأشد العناصر كهرجابية السيزيوم وقيمة كهرسلبيته 0.7، ووضعت فيما بعد جداول أخرى للكهرسلبية، والقيم في الجداول جميعها متقاربة والاختلاف بينها بسيط.
وتزداد الكهرسلبية في الدور بالجدول الدوري من اليسار إلى اليمين، وهي تنقص بالانتقال من أعلى الفصيلة إلى أسفلها.
وتتفاوت اللامعادن بنشاطها الكيمياوي فيما بينها تفاوتاً كبيراً، فالفلور، على سبيل المثال، شديد الفعالية، فهو يتحد، تقريباً، وعلى نحو فوري مع كافة العناصر، في حين أن الهليوم خامل جداً لا يتفاعل مع أي من العناصر أو مركباتها، ويستفيد منه الكيميائيون لخموله بتوفير وسط غير فعّال (خامل) داخل بعض الأجهزة.
ولا يجوز اقتصار الاعتماد على الجدول الكهرحركي وجدول الكهرسلبية في استنتاج الخواص الكيمياوية للعنصر، إذ يجب أن تؤخذ بعين الاعتبار عوامل أخرى مثل حالة العنصر، ونقاوة الكواشف الكيمياوية، وطبيعة نواتج التفاعل التي قد تسبب سلبية العنصر، أو تضعف من نشاطه الكيمياوي بانحلالها البطيء.
ومما يجدر ذكره أن الروابط في أكاسيد اللامعادن، مثل الآزوت (النتروجين) والفسفور والكبريت وأكاسيد العناصر ذات الكهرسلبية المتوسطة أو العالية، هي روابط مشتركة. وأكاسيد اللامعادن النموذجية ذات خواص حمضي.
هيام بيرقدار
Nonmetal - Non-métal
اللامعدن
معظم عناصر الجدول الدوري[ر] معادن metals. أما عدد اللامعادن nonmetals فلا يتجاوز العشرين. وتوجد المعادن في الجدول الدوري إلى يسار الخط المنكسر (الشكل-1)، واللامعادن إلى يمين ذلك الخط.
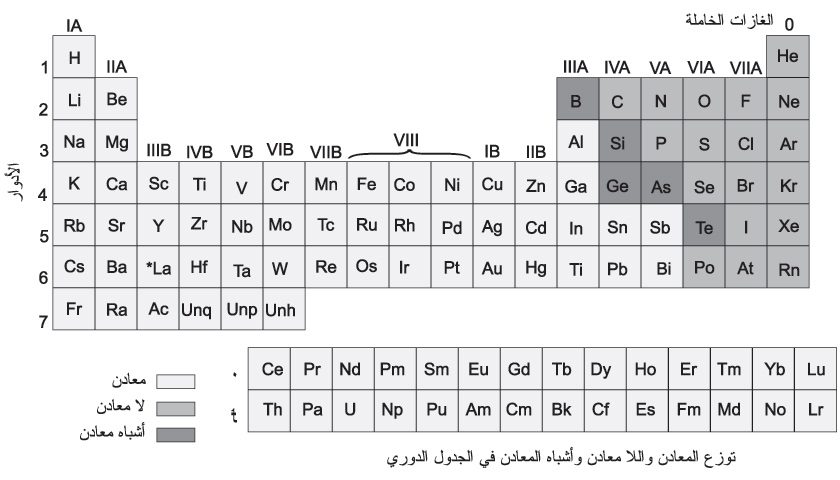 |
| الشكل (1) |
والعناصر الوسطية، القريبة من الخط المنكسر بخاصة، تتمتع بخواص المعادن واللامعادن في الوقت نفسه، ويطلق على هذه العناصر اسم أشباه المعادن metalloids وهي: البور B، السيلكون Si، الجرمانيوم Ge، الزرنيخ As، التلوريوم Te. وأشباه المعادن تشبه، نوعاً ما، اللامعادن في خواصها الفيزيائية والكيمياوية.
لعل من الأفضل بدلاً من تقسيم العناصر إلى معادن ولامعادن شرح الخواص المعدنية[ر:المعدن] والخواص اللامعدنية. فإذا أمكن إهمال الخواص اللامعدنية مقابل الخواص المعدنية، عدّ العنصر معدناً نموذجياً، وبالعكس. فمن المعادن النموذجية المعادن القلوية مثل الصوديوم والبوتاسيوم على الرغم من وزنها النوعي المنخفض نسبياً، ومن اللامعادن الكربون على الرغم من ناقليته الجيدة للكهرباء وارتفاع درجة انصهاره.
الخواص الفيزيائية للامعادن النموذجية
إن ما يميز الحالة المعدنية من اللامعدنية هو طبيعة الرابطة وشكل البنية البلورية، أما جميع الخواص الأخرى الملازمة للحالة المعدنية كالبريق المعدني والخواص الحرارية والكهربائية واللدونة فهي نتائج لطبيعة الرابطة المعدنية والبنية البلورية المعدنية.
اللامعادن، من حيث المظهر، غازات أو أجسام صلبة درجات انصهارها منخفضة، مثال ذلك الهالوجينات، وهي عناصر الفصيلة VII A التي تعدّ لامعادن نموذجية. فالفلور F2 والكلور Cl2 غازان، البروم Br2 سائل، واليودI2 صلب درجة انصهاره 113.75 ْس.
تتفق الرابطة المشتركة المميزة للاّمعادن مع الرابطة المعدنية من حيث الطبيعة إذ إن كلاً من الرابطتين يتولّد من اشتراك الذرات فيما بينها بإلكترونات التكافؤ، إلا أن الرابطة المشتركة رابطة متموضعة localized، تنشأ بين ذرتين متجاورتين وتبقى الإلكترونات المشتركة في جوارهما المباشر، مرتبطة بهما ارتباطاً متيناً، وهذه الرابطة المتينة بين ذرات الجسم الصلب لا تسمح بانزلاق الذرات بعضها حول بعض من دون تفكك الرابطة وتخرب بنيان هذا الجسم. وهذا ما يفسر كون البلورات الملحية واللامعادن الصلبة ذات الروابط المشتركة هشة وقابلة للكسر، بخلاف المعادن التي تتمتع بلدونة كبيرة بفضل الرابطة المعدنية[ر:الرابطة الكيمياوية].
اللامعادن، بخلاف المعادن، ليست لدنة لأن الرابطة المشتركة فيها لا تتحرك بتحرك إلكترونات التكافؤ، لذلك لا يمكن لذراتها أن تتحرك بالنسبة لبعضها بعضاً من دون أن تؤدي الحركة إلى انفصام الرابطة المشتركة وتصدُّع البنيان اللامعدني، فهي لذلك لا تقبل السحب والطَرْق والمعالجات الميكانيكية الأخرى سواء بالطريقة الباردة أو بالطريقة الساخنة.
اللامعادن، بخلاف المعادن، رديئة النقل للحرارة والكهرباء، ويعود السبب في ذلك إلى طبيعة الرابطة فيها، إذ تعلّل الناقلية الحرارية في النظريات التقليدية بسرعة تحرك الإلكترونات واصطدامها بعضها ببعض اصطداماً مرناً، وهذا التحرك السريع غير ممكن في اللامعادن. أما الناقلية الكهربائية فتنشأ من سهولة تحرك الإلكترونات في حقل كهربائي مؤثر في المادة، حتى لو كان هذا الحقل ضعيفاً، فالإلكترونات تتحرك من دون انتظام في كتلة المعدن في حال غياب الحقل الكهربائي، أما عند تطبيق فرق كمون معين بين طرفي قطعة معدنية، فإنه ينشأ حقل كهربائي ينظم حركة الإلكترونات باتجاه القطب الموجب مما، يولِّد التيار الكهربائي.
وتعلَّل الناقلية الحرارية والكهربائية العالية في المعادن وانخفاضها في أشباه المعادن واللامعادن حسب النظريات الحديثة، بأن حالة الإلكترونات الخارجية في الذرة الحرة لعنصر تختلف عن حالتها عندما تجتمع ذرات العنصر لتكوّن كتلة متراصَّة، في حين تحافظ الإلكترونات الداخلية على حالتها الطاقية، ففي الذرات الحرة تكون الإلكترونات الخارجية (إلكترونات التكافؤ) ذات طاقات محدّدة، أو بتعبير آخر، تشغل سويات طاقة محددة. أما في كتلة العنصر، عندما تصبح هذه الإلكترونات خاضعة لتأثير عدد كبير من النوى، فإن السويات الطاقية الممكنة لهذه الإلكترونات تزداد حتى قيم أعلى، أو بتعبير آخر، تشغل هذه الإلكترونات منطقة طاقية عريضة محددة أعلى من سويات الطاقة الموافقة في الذرات الحرة، وبالتالي تصبح الطاقة اللازمة لإثارة الإلكترون الخارجي كي ينتقل إلى حالة طاقية أعلى أو لخروجه من الغلاف الإلكتروني أصغر بكثير، ويكفي لذلك حقل كهربائي صغير أو طاقة حرارية صغيرة. ويبقى مبدأ باولي[ر: الذرة] مطبقاً على توزيع الإلكترونات في المناطق الطاقية، كما في حالة الذرات الحرة. وإذا كانت المناطق الطاقية الممكنة مشغولة بصورة تامة فإن الانتقال من حالة إلى أخرى يصبح غير ممكن، وتكون الناقلية الكهربائية والحرارية معدومة (كما في حالة اللامعادن)، وكلما كان الفرق بين سويتي الطاقة الموافقتين للحالة العادية والحالة المثارة صغيراً (في حالة وجود مناطق طاقية شاغرة) كانت الناقلية الحرارية والكهربائية أجود.
وعلى هذا فإن ما يميز المعدن من اللامعدن هو أن المعدن يحوي سويات طاقية إلكترونية شاغرة وسويات طاقية تشغلها الإلكترونات المثارة بامتصاص طاقة صغيرة نسبياً، في حين لا توجد في كتلة اللامعدن النموذجي (أو في المواد العازلة) سويات طاقة شاغرة. وتكون السويات المثارة الممكنة عالية لايمكن بلوغها إلا بامتصاص طاقة كبيرة، فاللامعدن لا يصبح ناقلاً إلا في درجات الحرارة العالية.
أشباه المعادن تنقل التيار الكهربائي، ولكن ليس بجودة المعادن، فمعظمها أنصاف نواقل[ر]. وللسيلسيوم[ر] Si والجرمانيوم[ر] Ge، خاصة، تطبيقات واسعة لكونهما أنصاف نواقل. تكون أبخرة المعادن النموذجية غالباً في الحالة الذرية بخلاف اللامعادن التي تكون في الحالة الغازية متعددة الذرات (باستثناء الغازات الخاملة أحادية الذرة).
الخواص الكيمياوية للامعادن النموذجية
إن ما يميز اللامعادن من الوجهة الكيماوية، هو ميل ذراتها إلى ضم إلكترون أو عدة إلكترونات متحولة إلى شوارد (أيونات) سالبة، كما في الأملاح. ولهذا كانت قيم كمونات تشردها ionization potential كبيرة (وكمون التشرد هو الطاقة اللازمة لنزع أضعف الإلكترونات ارتباطاً بالذرة وهي بالحالة الغازية وتحولها إلى شاردة موجبة وهي بالحالة الغازية). فكمون تشرد الذرة، مقدراً بالكيلوجول/مول، للآزوت (لامعدن) 1402، وللصوديوم (معدن نشيط)496، وللكلسيوم (معدن أقل فعالية من الصوديوم) 599، وللزرنيخ 947.
يتحدد ميل الذرة لضم الإلكترونات، كمياً، بقيمة كمون المسرى النظامي normal electrode potential الموافقة لها (بالفولط)، وتنظَّم هذه القيم في جدول، هو الجدول الكهرحركي[ر. الكيمياء الكهربائية]. فكمون مسرى السيزيوم (معدن) Cs+/Cs يساوي -2.923 فولط وكمون مسرى الصوديوم الأقل فعالية من السيزيوم Na+/Na-2.71 فولط، وكمون مسرى الفلور 2F-/F2 يساوي +2.87 فولط وكمون مسرى الهدروجين 2H+/H2 يساوي الصفر. فالمعادن الفعالة تقع فوق الهدروجين بالجدول الكهرحركي، ولها قيم كمون مسرى سالبة. والعناصر التي تقع تحت الهدروجين بالجدول الكهرحركي أقل كهرجابية من الهدروجين، ولها قيم كمون مسرى موجبة.
| K | 0.8 | As | 2.0 |
| Ba | 0.9 | C | 2.5 |
| Li | 1.0 | O | 3.5 |
| Sr | 1.0 | B | 2.0 |
| Ca | 1.0 | Te | 2.1 |
| Al | 1.5 | P | 2.1 |
| Ge | 1.7 | H | 2.1 |
| Sb | 1.8 | Se | 2.4 |
| Si | 1.8 | S | 2.5 |
| الجدول(1) | |||
| قيم الكهرسلبية لبعض العناصر (وفق بولنغ) |
|||
وتزداد الكهرسلبية في الدور بالجدول الدوري من اليسار إلى اليمين، وهي تنقص بالانتقال من أعلى الفصيلة إلى أسفلها.
وتتفاوت اللامعادن بنشاطها الكيمياوي فيما بينها تفاوتاً كبيراً، فالفلور، على سبيل المثال، شديد الفعالية، فهو يتحد، تقريباً، وعلى نحو فوري مع كافة العناصر، في حين أن الهليوم خامل جداً لا يتفاعل مع أي من العناصر أو مركباتها، ويستفيد منه الكيميائيون لخموله بتوفير وسط غير فعّال (خامل) داخل بعض الأجهزة.
ولا يجوز اقتصار الاعتماد على الجدول الكهرحركي وجدول الكهرسلبية في استنتاج الخواص الكيمياوية للعنصر، إذ يجب أن تؤخذ بعين الاعتبار عوامل أخرى مثل حالة العنصر، ونقاوة الكواشف الكيمياوية، وطبيعة نواتج التفاعل التي قد تسبب سلبية العنصر، أو تضعف من نشاطه الكيمياوي بانحلالها البطيء.
ومما يجدر ذكره أن الروابط في أكاسيد اللامعادن، مثل الآزوت (النتروجين) والفسفور والكبريت وأكاسيد العناصر ذات الكهرسلبية المتوسطة أو العالية، هي روابط مشتركة. وأكاسيد اللامعادن النموذجية ذات خواص حمضي.
هيام بيرقدار
