راديوم
Radium - Radium
الراديوم
الراديوم radium معدن يقع أسفل الفصيلة الرئيسة الثانية (العناصر القلوية الترابية)، وهو عنصر جميع نظائره مشعة ويرمز له بـ Ra. تكافؤه ثنائي، بنيته الإلكترونية [Rn]7s2. تدل [Rn] على البنية الإلكترونية للغاز الخامل الرادون Rn. وزنه الذري 226.0245، عدده الذري 88، كتلته الحجمية 5.5غ/سم3، درجة انصهاره 700 ْس، ودرجة غليانه 1140 ْس.
اكتشافه
جذب اكتشاف بكريل Bequerel للنشاط الإشعاعي انتباه علماء كثيرين، إذ إن انبعاث الإشعاعات ذات النفاذية الشديدة من المعادن الطبيعية كان غامضاً وغير مفهوم على الإطلاق. ومن هنا بدأت ماري كوري M.Curie عام (1867- 1934) موضوعها في بحث الدكتوراه على هذه المعادن النشطة إشعاعياً. وسرعان ما اكتشفت أن خامة اليورانيوم الطبيعي U3O8 (pitchblende) من مدينة ياخيموف التشيكية Jachimov تصدر إشعاعاً أقوى بمرتين مما ينبعث من اليورانيوم النقي، مما يدل على أن الخامة تحوي مادة ذات نشاط إشعاعي أشد من اليورانيوم.
بدأت ماري مع زوجها بيير كوري (1859-1906) ببحث هذا اللغز، فاستطاعا بعد عمل طويل وشاق الحصول على مركب شديد الإشعاع من البزموت، الذي يحوي عنصراً غير معروف، فأطلقا عليه اسم البولونيوم تكريماً لبولونيا وطن ماري.
وفي عام 1898 استطاع الزوجان فصل الباريوم مع الراديوم وبعض العناصر الأخرى على شكل كبريتات راسبة. وبعد عمليات تنقية إضافية بقي في الراسب أملاح الراديوم والباريوم فقط. ويحوَّل هذان الملحان إلى كلوريدات بغلي الراسب مع محلول كربونات الصوديوم. وبالتحليل الكهربائي لمحلول كلوريد الراديوم باستعمال مهبط زئبقي، تتشكل ملغمة راديوم، وبتسخين الملغمة ينطلق الزئبق ويبقى الراديوم حراً. ويسود المعدن بسرعة لتشكل نتريد الراديوم Ra3N2. ويتم الحصول على غرام واحد راديوم من 7 طن من أكسيد اليورانيوم المتوفر في الطبيعة U3O8.
خصائص الراديوم
الراديوم معدن فضي لماع يتلون باللون الأسود في الهواء نتيجة تشكل نتريد الراديوم ببطء Ra3N2.
يعد الراديوم أنشط عناصر مجموعته نظراً لموقعه في أسفل الفصيلة، وهو يشبه في كيميائه عنصر الباريوم. وهو عنصر مرجع قوي يشكل الشاردة Ra+2، ويتفاعل مع الماء والحموض بشكل ضعيف ويطلق الهدروجين. إن قابلية انحلال أملاح الراديوم في الماء مشابهة لتلك المتعلقة بمركبات الكالسيوم أو الباريوم.
إن نظائر الراديوم جميعها مشعة، والنظير الأثبت هو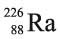 الذي ينشأ من تفكك اليورانيوم 238 وفق التحولات النووية (1).
الذي ينشأ من تفكك اليورانيوم 238 وفق التحولات النووية (1).
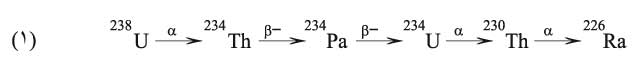
ويعد الراديوم من العناصر النادرة إذ لا تتجاوز نسبته في القشرة الأرضية 7×10-12%.
أهم مركبات الراديوم
لم تدرس مركبات الراديوم كثيراً لندرته، إلا أن أهم أملاحه هي:
ـ بروميد الراديوم RaBr2: يميل إلى الأصفر الفاتح، صعب الانحلال في الماء، بلوراته أحادية الميل، درجة انصهاره 728 ْس، يتبلور مع جزيئين من الماء، ويفقدهما عند التسخين بالدرجة 100 ْس.
- كربونات الراديوم RaCO3: لا لون لها، صعبة الانحلال في الماء، بلوراتها أحادية الميل.
- كلوريد الراديوم RaCl2: مائل إلى الأصفر الباهت، ينحل في الماء، بلوراته أحادية الميل. درجة انصهاره 1000 ْس، يتبلور مع جزيئين من الماء يفقدهما عند التسخين للدرجة 100 ْس.
- كبريتات الراديوم RaSO4: لا لون لها، صعبة الانحلال في الماء، بلوراتها معينية.
نظائره
يوضح الجدول (1) النظائر الطبيعية لعنصر الراديوم مع زمن عمر النصف half life العائد لكل نظير.
أهمية الراديوم واستعمالاته
يستعمل الراديوم في المفاعلات النووية بسبب شدة نشاطه الإشعاعي. فعلى سبيل المثال يستعمل مزيج الراديوم والبريليوم لتوليد النترونات، ويستعمل أيضاً مصدراً للإشعاع في الطب، وللحصول على عناصر جديدة بسبب نشاطه الإشعاعي.
خليل صهيون
Radium - Radium
الراديوم
الراديوم radium معدن يقع أسفل الفصيلة الرئيسة الثانية (العناصر القلوية الترابية)، وهو عنصر جميع نظائره مشعة ويرمز له بـ Ra. تكافؤه ثنائي، بنيته الإلكترونية [Rn]7s2. تدل [Rn] على البنية الإلكترونية للغاز الخامل الرادون Rn. وزنه الذري 226.0245، عدده الذري 88، كتلته الحجمية 5.5غ/سم3، درجة انصهاره 700 ْس، ودرجة غليانه 1140 ْس.
اكتشافه
جذب اكتشاف بكريل Bequerel للنشاط الإشعاعي انتباه علماء كثيرين، إذ إن انبعاث الإشعاعات ذات النفاذية الشديدة من المعادن الطبيعية كان غامضاً وغير مفهوم على الإطلاق. ومن هنا بدأت ماري كوري M.Curie عام (1867- 1934) موضوعها في بحث الدكتوراه على هذه المعادن النشطة إشعاعياً. وسرعان ما اكتشفت أن خامة اليورانيوم الطبيعي U3O8 (pitchblende) من مدينة ياخيموف التشيكية Jachimov تصدر إشعاعاً أقوى بمرتين مما ينبعث من اليورانيوم النقي، مما يدل على أن الخامة تحوي مادة ذات نشاط إشعاعي أشد من اليورانيوم.
بدأت ماري مع زوجها بيير كوري (1859-1906) ببحث هذا اللغز، فاستطاعا بعد عمل طويل وشاق الحصول على مركب شديد الإشعاع من البزموت، الذي يحوي عنصراً غير معروف، فأطلقا عليه اسم البولونيوم تكريماً لبولونيا وطن ماري.
وفي عام 1898 استطاع الزوجان فصل الباريوم مع الراديوم وبعض العناصر الأخرى على شكل كبريتات راسبة. وبعد عمليات تنقية إضافية بقي في الراسب أملاح الراديوم والباريوم فقط. ويحوَّل هذان الملحان إلى كلوريدات بغلي الراسب مع محلول كربونات الصوديوم. وبالتحليل الكهربائي لمحلول كلوريد الراديوم باستعمال مهبط زئبقي، تتشكل ملغمة راديوم، وبتسخين الملغمة ينطلق الزئبق ويبقى الراديوم حراً. ويسود المعدن بسرعة لتشكل نتريد الراديوم Ra3N2. ويتم الحصول على غرام واحد راديوم من 7 طن من أكسيد اليورانيوم المتوفر في الطبيعة U3O8.
خصائص الراديوم
الراديوم معدن فضي لماع يتلون باللون الأسود في الهواء نتيجة تشكل نتريد الراديوم ببطء Ra3N2.
يعد الراديوم أنشط عناصر مجموعته نظراً لموقعه في أسفل الفصيلة، وهو يشبه في كيميائه عنصر الباريوم. وهو عنصر مرجع قوي يشكل الشاردة Ra+2، ويتفاعل مع الماء والحموض بشكل ضعيف ويطلق الهدروجين. إن قابلية انحلال أملاح الراديوم في الماء مشابهة لتلك المتعلقة بمركبات الكالسيوم أو الباريوم.
إن نظائر الراديوم جميعها مشعة، والنظير الأثبت هو
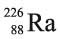 الذي ينشأ من تفكك اليورانيوم 238 وفق التحولات النووية (1).
الذي ينشأ من تفكك اليورانيوم 238 وفق التحولات النووية (1).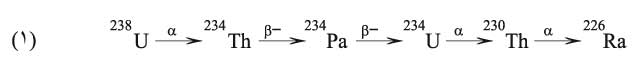
ويعد الراديوم من العناصر النادرة إذ لا تتجاوز نسبته في القشرة الأرضية 7×10-12%.
أهم مركبات الراديوم
لم تدرس مركبات الراديوم كثيراً لندرته، إلا أن أهم أملاحه هي:
ـ بروميد الراديوم RaBr2: يميل إلى الأصفر الفاتح، صعب الانحلال في الماء، بلوراته أحادية الميل، درجة انصهاره 728 ْس، يتبلور مع جزيئين من الماء، ويفقدهما عند التسخين بالدرجة 100 ْس.
- كربونات الراديوم RaCO3: لا لون لها، صعبة الانحلال في الماء، بلوراتها أحادية الميل.
- كلوريد الراديوم RaCl2: مائل إلى الأصفر الباهت، ينحل في الماء، بلوراته أحادية الميل. درجة انصهاره 1000 ْس، يتبلور مع جزيئين من الماء يفقدهما عند التسخين للدرجة 100 ْس.
- كبريتات الراديوم RaSO4: لا لون لها، صعبة الانحلال في الماء، بلوراتها معينية.
نظائره
يوضح الجدول (1) النظائر الطبيعية لعنصر الراديوم مع زمن عمر النصف half life العائد لكل نظير.
| العدد الكتلي | عمر النصف | العدد الكتلي | عمر النصف |
| 213 | 2.7 دقيقة | 223 | 11.43 يوم |
| 214 | 2.6 ثانية | 224 | 3.64 يوم |
| 215 | 1.6 ميلي ثانية | 225 | 14.8 يوم |
| 216 | أقل من ميلي ثانية | 226 | 1600 سنة |
| 217 | قصير جداً | 227 | 41.2 سنة |
| 220 | 23 ميلي ثانية | 228 | 5.77 سنة |
| 221 | 30 ثانية | 230 | ساعة واحدة |
| 222 | 38 ثانية | ـ | ـ |
يستعمل الراديوم في المفاعلات النووية بسبب شدة نشاطه الإشعاعي. فعلى سبيل المثال يستعمل مزيج الراديوم والبريليوم لتوليد النترونات، ويستعمل أيضاً مصدراً للإشعاع في الطب، وللحصول على عناصر جديدة بسبب نشاطه الإشعاعي.
خليل صهيون
