حلمهه
Hydrolysis - Hydrolyse
الحلمهة
الحلمهة hydrolyse هي التفكك أو التفاعل الكيمياوي الحاصل لمادة ما لدى تماسها مع الماء. والأمثلة متنوعة على ذلك:
1- تفاعل الحموض والأسس[ر] (القواعد) مع الماء
تكون الحلمهة تامة مع الحموض والأسس القوية، وتكون محدودة أو متوازنة مع الحموض والأسس الضعيفة في تشردها (تأينها) في الماء، إذ تعطي هذه التفاعلات الصفات الحمضية أو الأساسية للمحلول بإنتاج الشوارد الحمضية H3O+أو الشوارد الأساسية OH-:
2- تفاعل الأملاح مع الماء
يمكن لكل شق أو لكل شاردة (أيون) من شوارد الملح أن تخضع لتفاعل الحلمهة بتماسها مع الماء اعتماداً على قوة هذه الشاردة كحمض أو كأساس، وبالتالي نستطيع أن نميز ما يأتي:
أ ـ إذا كان الملح مشتقاً من حمض ضعيف وأساس قوي:
مثال خلات الصوديوم: تُفسر آلية التفاعل مع الماء على نحو يتشرد فيه هذا الملح تشرداً تاماً في الماء معطياً شوارد الخلات وشوارد الصوديوم بالإضافة إلى تشرد الماء نفسه. وترتبط شوارد الخلات بشوارد الهدروجين الناتجة أصلاً عن تشرد الماء معطية حمض الخل. وبما أن شوارد الهدروجين قد استهلكت نتيجة هذا الارتباط مع شاردة الخلات، فإن جزيئات جديدة من الماء تتشرد من جديد إلى شوارد هدروكسيل وشوارد هدروجين لإعادة التوازن. وهذا يؤدي إلى تزايد شوارد الهدروكسيل التي ستظهر في التفاعل وتغدو طبيعة هذا الملح في الماء أساسية قوية لتحرر شوارد الهدروكسيل في الوسط المائي:
أما شوارد الصوديوم هنا فلن تعاني من فعل الحلمهة لأنها مشتقة من هدروكسيد قوي.
ب ـ إذا كان الملح مشتقاً من حمض قوي وأساس قوي لن يحدث أي تفاعل حلمهة مثل كلوريد الصوديوم (ملح الطعام) لأن هذا الملح يتشرد كلياً في الماء ولأن شوارده Na+ و Cl- مشتقة أصلاً وعلى التتابع من هدروكسيد قوي (أساس قوي NaOH) وحمض قوي HCl، وبالتالي فإن محلوله يكون معتدلاً.
جـ ـ إذا كان الملح مشتقاً من حمض ضعيف وأساس ضعيف:
يخضع هذا الملح، وبالتالي شوارده، لتفاعل الحلمهة بعملية تعويض، وسيكون تفاعلاً خاصاً ومحدوداً أي متوازناً ومعتدلاً، مثال خلات الأمونيوم CH3COONH4 حيث تخضع الشاردتان للتفاعل مع الماء على نحو مماثل لما ذكر في آلية الفقرة أ:
للتفاعل مع الماء على نحو مماثل لما ذكر في آلية الفقرة أ:
د ـ إذا كان الملح مشتقاً من حمض قوي وأساس ضعيف:
يخضع كذلك هذا الملح لتفاعل الحلمهة، ويكون محلوله من طبيعة حمضية مثل كلور الأمونيوم المشتق من حمض كلور الماء القوي وهدروكسيد الأمونيوم الأساس الضعيف. وتقوم الشاردة بدور الحمض الضعيف وتتفاعل مع الماء محررة شوارد الهدرونيوم التي تدل على الطبيعة الحمضية:
بدور الحمض الضعيف وتتفاعل مع الماء محررة شوارد الهدرونيوم التي تدل على الطبيعة الحمضية:
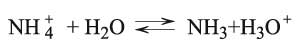
في حين لن تخضع الشاردة Cl‑ لتفاعل الحلمهة لأنها مشتقة من الحمض القوي.
وتجدر الإشارة إلى أن بعض الأملاح خارج نطاق التصنيف السابق تخضع لفعل حلمهة شبه تام كالهدريدات والنتريدات والكربيدات والسيليسيدات والفسفيدات المعدنية، وكذلك هاليدات اللامعادن، ونذكر بعضاً من هذه الأمثلة: تفاعل حلمهة كربيد الكلسيوم لإنتاج الأستلين:
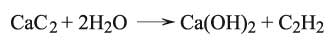
وكذلك حلمهة نتريد المغنزيوم:
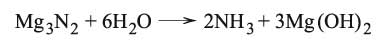
وكذلك في حالة هدريد الليثيوم:

وتخضع المركبات العضوية أيضاً لتفاعلات الحلمهة ونسوق على سبيل المثال لا الحصر: هاليدات الأغوال وأكاسيد الإتيرات والأستيرات والغلوكوزيدات والبروتينات. ونذكر أن خاصة حلمهة أستر، ما هو إلا التفاعل العكسي لأسترة الغول:
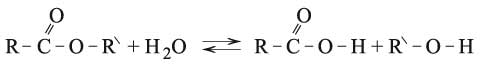
وتقود الحلمهة في حالة الأجسام الدسمة في أثناء التحضيرات الصناعية، إلى الغلسيرول والحموض الدسمة ستياريك (الشموع).
وتكون تفاعلات الحلمهة في المركبات العضوية ذات الطبيعة المشتركة بطيئة، وإن إضافة كمية قليلة من الحمض أو الأساس سيسرع التفاعل ضمن آلية الوساطة حمض - أساس. وأخيراً نذكر تفاعلات الحلمهة الهامة للغليكوزيدات والبروتينات في العضوية الحية بفعل الأنزيمات[ر] النوعية في عدد من العمليات الحيوية الكيمياوية والتي تمثل إحداها عملية الهضم.
بما أن ثابت توازن الحلمهة محدود، فيمكن التعبير عن درجة الحلمهة بـ h على أنها الجزء من الحمض أو الأساس الذي يتفاعل مع الماء في أثناء التوازن. فإذا عبرنا عن الملح بـ AB كناتج عن الحمض الضعيف HA (مثل CH3COONa) فإن ثابت توازن الحلمهة للتفاعل الآتي:

يعطى بالعلاقة الآتية:
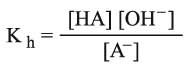
واعتماداً على ثابت توازن أو تشرد الماء Kw = [H+] [OH-] وثابت تشرد الحمض (Ka)HA:
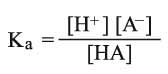
وبالتبديل يغدو ثابت توازن الحلمهة:
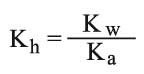
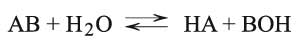
ويمكن مناقشة الأمر نفسه في حالة حلمهة الملح AB المشتق من الأساس الضعيف BOH (حالة الملح NH4Cl):
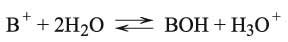
ويصبح ثابت توازن الحلمهة:
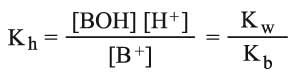
حيث يشير Kb إلى ثابت توازن القاعدة BOH.
وأخيراً درجة الحلمهة للملح AB المشتق من حمض وأساس ضعيفين:
يعطى حينها ثابت توازن الحلمهة بالعلاقة:
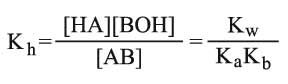
آلية الحلمهة
يمكن أن تلخص آلية الحلمهة للتفاعلات التي ذكرت اعتماداً على نظرية لويس حيث يكون الكاتيون Mn+ مستقبلاً للإلكترونات ويقوم مقام الحمض، في حين يقوم جزيء الماء بدور المانح للإلكترونات من خلال الأزواج الإلكترونية الحرة غير الرابطة حول ذرة الأكسجين، ويقوم هنا بدور الأساس. واعتماداً على الحقل الكهربائي فإن الشاردة Mn+ تجذب إلى محيطها جزيئات الماء ثنائية القطب بفعل الكهرباء الساكنة. فإذا كان الحقل الكهربائي ضعيفاً تتحول الشاردة Mn+إلى شاردة محلحلة ion solvate، وتكون معظم أملاح هذه الشاردة ذوابة في الماء. (شاردة الصوديوم مثلاً):
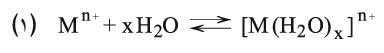
أما إذا كان الحقل الكهربائي للشاردة Mn+ قوياً، فإن التجاذب سيكون فعالاً، وتنتقل الرابطة M-O من النوع الكهربائي الساكن (الشاردي) إلى النوع المشترك مع تشوه القيمة الإلكترونية المحيطة بذرة الأكسجين، وبالمقابل فإن الصفة الشاردية للرابطة O-H تزداد (انتقال الزوج الإلكتروني للرابطة نحو ذرة الأكسجين) وبالتالي تنفصل هذه الرابطة في المُحل المُشرِّد وهو هنا الماء مع تحرر البروتونات أو شوارد الهدرونيوم:

وتكون الهدروكسيدات المتشكلة عادة ضعيفة الذوبان في شروط الماء العادي (n4
. وأخيراً إذا كان الحقل الكهربائي الذي تخلقه Mn+ حولها قوياً جداً؛ فإن التجاذب يصبح أكثر فاعلية وتتشرد بعض الروابط O-H في M(OH)2 لتعطي أنيونيات (شوارد سالبة) أكسجينية مثل:
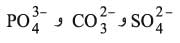 الموافقة للشوارد الافتراضية:
الموافقة للشوارد الافتراضية: 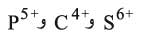
الكمون الشاردي
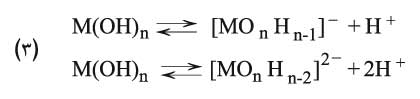
تتعلق قوة جذب الشاردة الموجبة Mn+ لجزيء الماء بشحنة هذه الشاردة وبنصف قطرها r. فكلما كانت الشحنة كبيرة ونصف القطر صغيراً، ازدادت قوة التجاذب. وبتقريب أولي تتناسب قوة الجذب مع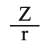 الذي يدعى بالكمون الشاردي. لقد تم تصنيف الشوارد اعتماداً على المخطط Z= f (r) إلى ثلاثة أقسام، توافق ثلاثة أنواع من تفاعلات الحلمهة، تقع ضمن ثلاث مناطق (أو مجالات) تبعاً لـهذا الـمخطط (1):
الذي يدعى بالكمون الشاردي. لقد تم تصنيف الشوارد اعتماداً على المخطط Z= f (r) إلى ثلاثة أقسام، توافق ثلاثة أنواع من تفاعلات الحلمهة، تقع ضمن ثلاث مناطق (أو مجالات) تبعاً لـهذا الـمخطط (1):
ـ المنطقة الأولى I توافق النسبة الأقل من 3 مثل الكاتيونات المميهة المهاجرة Na+ و Ca2+ و Mg2+ (التفاعل 1) والتي توجد في حوض الرسوبيات لتشكيل الجير الدولومي المُميِّز للصخور الرسوبية. وينتمي لهذه المجموعة شوارد البوتاسيوم والروبيديوم (نصف القطر نحو 0.148 نانومتر) وشاردة السيزيوم ( 0.164 = rنانومتر) ويكون كمونها الشاردي أقل من الواحد. ولا تميل هذه الشوارد - على العكس من غيرها - لفعل الحلحلة إذ تتمتع بنصف قطر مُقْنَع (مضاد للاحتباس anti-stores) وهي مهاجرة بفعل ذوبانية أملاحها، ولدى وصولها البحر تُمتص على الرسوبيات. وبما أنها غير محاطة بجزيئات الماء فيصغر نصف قطرها كثيراً. إن هذا التقسيم يشرح لماذا تكون الرسوبيات البحرية غنية بالبوتاسيوم وفقيرة بالصوديوم (وسطياً)، وعلى العكس من ذلك في حالة ماء البحر حيث 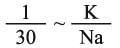 .
.
ـ المنطقة الثانية II حيث: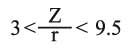
تضم هذه المنطقة الشوارد المترسبة على شكل هدروكسيدات في شروط pH الماء الطبيعي (التفاعل 2). وتبقى الشوارد Ti4+, Fe3+, Al3+ إلخ.. في مكانها خلال عملية التحول، حيث يغدو فيها السيليس فقيراً بسبب الذوبانية التي تتأثر بالطقس الحار والرطب (Si4+ على حدود المنطقتين II وIII من المخطط). وهكذا يتشكل الكاولينيت والبوكسيت.
ـ المنطقة الثالثة تحتوي هذه المنطقة على الشوارد الأكسجينية المهاجرة مثل
تحتوي هذه المنطقة على الشوارد الأكسجينية المهاجرة مثل 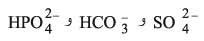 حيث توجد في حوض الرسوبيات وفق شروط pH وكمون الأكسدة والإرجاع لترسيب شواردة المنطقة I على شكل الجير والأباتيت والجبس وغيرها (تفاعل 3).
حيث توجد في حوض الرسوبيات وفق شروط pH وكمون الأكسدة والإرجاع لترسيب شواردة المنطقة I على شكل الجير والأباتيت والجبس وغيرها (تفاعل 3).
عبد المجيد البلخي
Hydrolysis - Hydrolyse
الحلمهة
الحلمهة hydrolyse هي التفكك أو التفاعل الكيمياوي الحاصل لمادة ما لدى تماسها مع الماء. والأمثلة متنوعة على ذلك:
1- تفاعل الحموض والأسس[ر] (القواعد) مع الماء
تكون الحلمهة تامة مع الحموض والأسس القوية، وتكون محدودة أو متوازنة مع الحموض والأسس الضعيفة في تشردها (تأينها) في الماء، إذ تعطي هذه التفاعلات الصفات الحمضية أو الأساسية للمحلول بإنتاج الشوارد الحمضية H3O+أو الشوارد الأساسية OH-:
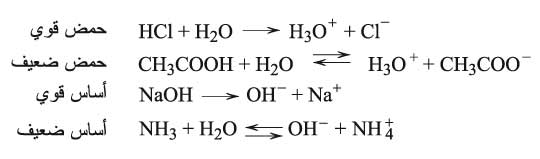
2- تفاعل الأملاح مع الماء
يمكن لكل شق أو لكل شاردة (أيون) من شوارد الملح أن تخضع لتفاعل الحلمهة بتماسها مع الماء اعتماداً على قوة هذه الشاردة كحمض أو كأساس، وبالتالي نستطيع أن نميز ما يأتي:
أ ـ إذا كان الملح مشتقاً من حمض ضعيف وأساس قوي:
مثال خلات الصوديوم: تُفسر آلية التفاعل مع الماء على نحو يتشرد فيه هذا الملح تشرداً تاماً في الماء معطياً شوارد الخلات وشوارد الصوديوم بالإضافة إلى تشرد الماء نفسه. وترتبط شوارد الخلات بشوارد الهدروجين الناتجة أصلاً عن تشرد الماء معطية حمض الخل. وبما أن شوارد الهدروجين قد استهلكت نتيجة هذا الارتباط مع شاردة الخلات، فإن جزيئات جديدة من الماء تتشرد من جديد إلى شوارد هدروكسيل وشوارد هدروجين لإعادة التوازن. وهذا يؤدي إلى تزايد شوارد الهدروكسيل التي ستظهر في التفاعل وتغدو طبيعة هذا الملح في الماء أساسية قوية لتحرر شوارد الهدروكسيل في الوسط المائي:
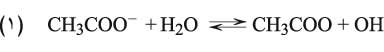
أما شوارد الصوديوم هنا فلن تعاني من فعل الحلمهة لأنها مشتقة من هدروكسيد قوي.
ب ـ إذا كان الملح مشتقاً من حمض قوي وأساس قوي لن يحدث أي تفاعل حلمهة مثل كلوريد الصوديوم (ملح الطعام) لأن هذا الملح يتشرد كلياً في الماء ولأن شوارده Na+ و Cl- مشتقة أصلاً وعلى التتابع من هدروكسيد قوي (أساس قوي NaOH) وحمض قوي HCl، وبالتالي فإن محلوله يكون معتدلاً.
جـ ـ إذا كان الملح مشتقاً من حمض ضعيف وأساس ضعيف:
يخضع هذا الملح، وبالتالي شوارده، لتفاعل الحلمهة بعملية تعويض، وسيكون تفاعلاً خاصاً ومحدوداً أي متوازناً ومعتدلاً، مثال خلات الأمونيوم CH3COONH4 حيث تخضع الشاردتان
 للتفاعل مع الماء على نحو مماثل لما ذكر في آلية الفقرة أ:
للتفاعل مع الماء على نحو مماثل لما ذكر في آلية الفقرة أ: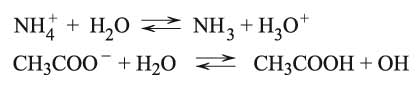
د ـ إذا كان الملح مشتقاً من حمض قوي وأساس ضعيف:
يخضع كذلك هذا الملح لتفاعل الحلمهة، ويكون محلوله من طبيعة حمضية مثل كلور الأمونيوم المشتق من حمض كلور الماء القوي وهدروكسيد الأمونيوم الأساس الضعيف. وتقوم الشاردة
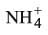 بدور الحمض الضعيف وتتفاعل مع الماء محررة شوارد الهدرونيوم التي تدل على الطبيعة الحمضية:
بدور الحمض الضعيف وتتفاعل مع الماء محررة شوارد الهدرونيوم التي تدل على الطبيعة الحمضية:
في حين لن تخضع الشاردة Cl‑ لتفاعل الحلمهة لأنها مشتقة من الحمض القوي.
وتجدر الإشارة إلى أن بعض الأملاح خارج نطاق التصنيف السابق تخضع لفعل حلمهة شبه تام كالهدريدات والنتريدات والكربيدات والسيليسيدات والفسفيدات المعدنية، وكذلك هاليدات اللامعادن، ونذكر بعضاً من هذه الأمثلة: تفاعل حلمهة كربيد الكلسيوم لإنتاج الأستلين:
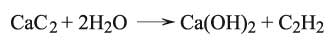
وكذلك حلمهة نتريد المغنزيوم:
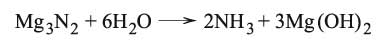
وكذلك في حالة هدريد الليثيوم:

وتخضع المركبات العضوية أيضاً لتفاعلات الحلمهة ونسوق على سبيل المثال لا الحصر: هاليدات الأغوال وأكاسيد الإتيرات والأستيرات والغلوكوزيدات والبروتينات. ونذكر أن خاصة حلمهة أستر، ما هو إلا التفاعل العكسي لأسترة الغول:
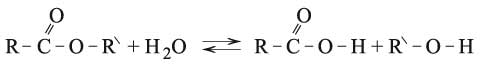
وتقود الحلمهة في حالة الأجسام الدسمة في أثناء التحضيرات الصناعية، إلى الغلسيرول والحموض الدسمة ستياريك (الشموع).
وتكون تفاعلات الحلمهة في المركبات العضوية ذات الطبيعة المشتركة بطيئة، وإن إضافة كمية قليلة من الحمض أو الأساس سيسرع التفاعل ضمن آلية الوساطة حمض - أساس. وأخيراً نذكر تفاعلات الحلمهة الهامة للغليكوزيدات والبروتينات في العضوية الحية بفعل الأنزيمات[ر] النوعية في عدد من العمليات الحيوية الكيمياوية والتي تمثل إحداها عملية الهضم.
بما أن ثابت توازن الحلمهة محدود، فيمكن التعبير عن درجة الحلمهة بـ h على أنها الجزء من الحمض أو الأساس الذي يتفاعل مع الماء في أثناء التوازن. فإذا عبرنا عن الملح بـ AB كناتج عن الحمض الضعيف HA (مثل CH3COONa) فإن ثابت توازن الحلمهة للتفاعل الآتي:

يعطى بالعلاقة الآتية:
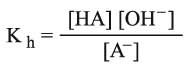
واعتماداً على ثابت توازن أو تشرد الماء Kw = [H+] [OH-] وثابت تشرد الحمض (Ka)HA:
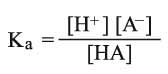
وبالتبديل يغدو ثابت توازن الحلمهة:
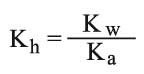
ويمكن مناقشة الأمر نفسه في حالة حلمهة الملح AB المشتق من الأساس الضعيف BOH (حالة الملح NH4Cl):

ويصبح ثابت توازن الحلمهة:
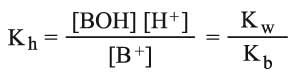
حيث يشير Kb إلى ثابت توازن القاعدة BOH.
وأخيراً درجة الحلمهة للملح AB المشتق من حمض وأساس ضعيفين:

يعطى حينها ثابت توازن الحلمهة بالعلاقة:
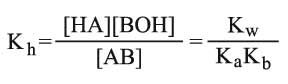
آلية الحلمهة
يمكن أن تلخص آلية الحلمهة للتفاعلات التي ذكرت اعتماداً على نظرية لويس حيث يكون الكاتيون Mn+ مستقبلاً للإلكترونات ويقوم مقام الحمض، في حين يقوم جزيء الماء بدور المانح للإلكترونات من خلال الأزواج الإلكترونية الحرة غير الرابطة حول ذرة الأكسجين، ويقوم هنا بدور الأساس. واعتماداً على الحقل الكهربائي فإن الشاردة Mn+ تجذب إلى محيطها جزيئات الماء ثنائية القطب بفعل الكهرباء الساكنة. فإذا كان الحقل الكهربائي ضعيفاً تتحول الشاردة Mn+إلى شاردة محلحلة ion solvate، وتكون معظم أملاح هذه الشاردة ذوابة في الماء. (شاردة الصوديوم مثلاً):
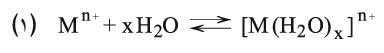
أما إذا كان الحقل الكهربائي للشاردة Mn+ قوياً، فإن التجاذب سيكون فعالاً، وتنتقل الرابطة M-O من النوع الكهربائي الساكن (الشاردي) إلى النوع المشترك مع تشوه القيمة الإلكترونية المحيطة بذرة الأكسجين، وبالمقابل فإن الصفة الشاردية للرابطة O-H تزداد (انتقال الزوج الإلكتروني للرابطة نحو ذرة الأكسجين) وبالتالي تنفصل هذه الرابطة في المُحل المُشرِّد وهو هنا الماء مع تحرر البروتونات أو شوارد الهدرونيوم:

وتكون الهدروكسيدات المتشكلة عادة ضعيفة الذوبان في شروط الماء العادي (n4
. وأخيراً إذا كان الحقل الكهربائي الذي تخلقه Mn+ حولها قوياً جداً؛ فإن التجاذب يصبح أكثر فاعلية وتتشرد بعض الروابط O-H في M(OH)2 لتعطي أنيونيات (شوارد سالبة) أكسجينية مثل:
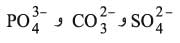 الموافقة للشوارد الافتراضية:
الموافقة للشوارد الافتراضية: 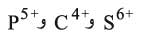

الكمون الشاردي
تتعلق قوة جذب الشاردة الموجبة Mn+ لجزيء الماء بشحنة هذه الشاردة وبنصف قطرها r. فكلما كانت الشحنة كبيرة ونصف القطر صغيراً، ازدادت قوة التجاذب. وبتقريب أولي تتناسب قوة الجذب مع
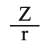 الذي يدعى بالكمون الشاردي. لقد تم تصنيف الشوارد اعتماداً على المخطط Z= f (r) إلى ثلاثة أقسام، توافق ثلاثة أنواع من تفاعلات الحلمهة، تقع ضمن ثلاث مناطق (أو مجالات) تبعاً لـهذا الـمخطط (1):
الذي يدعى بالكمون الشاردي. لقد تم تصنيف الشوارد اعتماداً على المخطط Z= f (r) إلى ثلاثة أقسام، توافق ثلاثة أنواع من تفاعلات الحلمهة، تقع ضمن ثلاث مناطق (أو مجالات) تبعاً لـهذا الـمخطط (1):  المخطط (1) تصنيف العناصر اعتماداً على كمونها الشاردي المخطط (1) تصنيف العناصر اعتماداً على كمونها الشاردي |
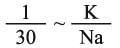 .
.ـ المنطقة الثانية II حيث:
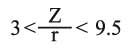
تضم هذه المنطقة الشوارد المترسبة على شكل هدروكسيدات في شروط pH الماء الطبيعي (التفاعل 2). وتبقى الشوارد Ti4+, Fe3+, Al3+ إلخ.. في مكانها خلال عملية التحول، حيث يغدو فيها السيليس فقيراً بسبب الذوبانية التي تتأثر بالطقس الحار والرطب (Si4+ على حدود المنطقتين II وIII من المخطط). وهكذا يتشكل الكاولينيت والبوكسيت.
ـ المنطقة الثالثة
 تحتوي هذه المنطقة على الشوارد الأكسجينية المهاجرة مثل
تحتوي هذه المنطقة على الشوارد الأكسجينية المهاجرة مثل 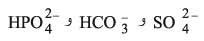 حيث توجد في حوض الرسوبيات وفق شروط pH وكمون الأكسدة والإرجاع لترسيب شواردة المنطقة I على شكل الجير والأباتيت والجبس وغيرها (تفاعل 3).
حيث توجد في حوض الرسوبيات وفق شروط pH وكمون الأكسدة والإرجاع لترسيب شواردة المنطقة I على شكل الجير والأباتيت والجبس وغيرها (تفاعل 3).عبد المجيد البلخي
