وظايف رباعيه تكافو
Tetravalent functions - Fonctions quadrivalentes
الوظائف الرباعية التكافؤ
وظايف رباعيه تكافو
Tetravalent functions - Fonctions quadrivalentes
الوظائف الرباعية التكافؤ
الوظائف الرباعية التكافؤ tetravalent functions في الكيمياء هي وظائف عضوية يمكن عدّها مشتقة من الميتان. قد يرتبط الميتان بجذر X) X هو ذرة غير متجانسة أحادية التكافؤ)، وقد يرتبط بجذر Y) Y ذرة ثنائية التكافؤ أو ثلاثية التكافؤ)، وعلى هذا يمكن تقسيم هذه المركبات إلى أربعة أصناف:
CX4 X2C=Y Y=C=Y X−C≡N
عدد هذه المركبات كبير، ويوجز فيما يأتي أهمها:
1ـ ضروب رباعي هاليد الألكيل: CI4 , CBr4 , CCl4 , CF4 وأكثرها أهمية هو رباعي كلوريد الكربون. ويمكن الحصول عليه بمعالجة كبريت الكربون بـ S2Cl2:
رباعي كلوريد الكربون سائل لا لون له، غير قابل للاشتعال وله رائحة مقبولة وهو مسَرْطن. يستخدم على نطاق واسع مُحِلاً (مُذيباً) في الصناعة وفي أجهزة إطفاء الحريق. وعند استخدامه لهذا الغرض في أمكنة مغلقة يجب توخي الحذر الشديد،لأنه بوجود الماء فوق الدرجة 500 ْس يعطي غاز الفوسجين الشديد السمية.
وتؤدي معالجته بغاز الكبريت إلى تشكل الفوسجين أيضاً.
2 ـ إسترات أورتو حمض الكربون C(OR)4 orthocarbonic acid
يمكن الحصول عليها بمعالجة كلوروبيكرين ( نتروكلورفورم)
وهذه المركبات سوائل لا لون لها وذات روائح لطيفة، وهي تتحلمه (تتحلَّل مائياً) بسهولة بالماء:
حيث -RO ألكوكسيد.
تتفاعل إسترات أورتو حمض الكربون مع الألدهيدات معطية الأستالات acetals ومع الكيتونات معطية الكيتالات ketals [ر: الكربونيلية (المشتقات ـ)] وكربونات ثنائية الألكيل (الإستر الثنائي لحمض الكربون).
حيث ´R ألكيل أو بروتون (H).
3 ـ الكلوروبكرين ( نتروكلوروفورم) CCl3NO2 chloropicrin
يمكن الحصول عليه بتفاعل الكلورفورم مع حمض الآزوت، وهو سام وله تأثير مبيد للحشرات:
وهو مركب غير قابل للاشتعال، ينحل في الكحول والبنزن والإيتر وقليل الانحلال بالماء.
4 ـ الفوسجين (كلوريد الكربونيل) COCl2 phosgene
ويحضر بتفاعل أحادي أكسيد الكربون مع الكلور بوجود الضوء ( ديفي 1812). ويتم هذا التفاعل في الصناعة عند درجة حرارة تراوح بين 100ـ200 س بوجود الكربون الفعال حفّازاً (وسيطاً).
أما مخبرياً فيحضر بتفاعل رباعي كلوريد الكربون بالأوليوم:
والفوسجين [ر: الغازات السامة] غاز لا لون له ( د.غ 8.2 ْس) وله رائحة خانقة. وهو مركب سام جداً وتأثيره خانق يخدش الرئتين مؤدياً إلى الموت. وقد استخدم مادة سامة في الحرب العالمية الأولى.
وبغض النظر عن خاصيته السمية فهو يستخدم في الصناعة، وفي اصطناع الكثير من المركبات العضوية. فيستخدم مثلاً في تفاعل فريدل ـ كرافتس مثل كلوريد الأسيتيل، وفي الحصول على إسترات كلورو حمض النمل ClCOOR.
وكذلك إسترات حمض الكربون CO(OR)2
وتعود أهمية الفوسجين الصناعية إلى استخدامه في الحصول على بولي كربونات التي تستخدم في الحصول على البولي يوريتانات وهو الإسفنج الصناعي عبر مرحلة دي إيزوسيانات.
5 ـ مشتقات حمض الكرباميك
لم يعرف حمض الكرباميك H2NCOOH في الحالة الحرة حتى اليوم. وكذلك فإن منتجات استبداله عند N التي تتكون على هيئة مركبات ثانوية ( في بعض إعادات الترتيب عند ذرة الآزوت) تفقد كربوكسيلها. أما أملاح حمض الكرباميك (الكربامات) فهي ثابتة، إذ يمكن اصطناع كربامات الأمونيوم بتفاعل الأمونيا مع CO2. تتحلمه كربامات الأمونيوم عند درجات عالية من الحرارة إلى كربونات الأمونيوم.
6ـ ضروب اليوريتان H2NCOOR urethanes
هي إسترات حمض الكرباميك، ويمكن اصطناعها من إسترات كلوروحمض النمل، أو بمعالجة إسترات حمض الكربون بالنشادر (الأمونيا).
تعطي تفاعلات ضروب اليوريتان بالأمونيا البولةََ:
ويستخدم بعض اليوريتانات مواد دوائية ( الكرباريل C6H7OOCNHCH3 carbaryl والميبروبامات) كما تستخدم مبيدات حشرية ( الكرباميل).
7 ـ البولة (اليوريا) O=C(NH2)2
وتدعى أيضاً بالكرباميد، وهي من أهم منتجا ت استقلاب[ر] المواد الغذائية الحاوية الآزوت في الثديات. وقد عزلها الكيميائي الفرنسي رويل Hilaire - Martin Rouelle أول مرة عام 1772 من بول الإنسان.
والبولة أول مركب عضوي اصطنع من مواد لا عضوية. ففي عام 1928 بخر الكيميائي الألماني فوهلر Wohler محلولاً مائياً لسيانات البوتاسيوم وكبريتات الأمونيوم فحصل على سيانات الأمونيوم التي تماكبت معطية البولة.
وبقي لهذا التفاعل في الوقت الحاضر أهمية تاريخية فقط.
أما في الصناعة فتحضر البولة بالحلمهة الجزئية لسيان أميد، أو بتسخين كربامات الأمونيوم (الناتجة من معالجة CO2 بالأمونيا) عند درجة حرارة 120ـ150 ْس وتحت ضغط 25ـ40كغ/سم2، حيث تخضع لنزع مائها كلياً.
ويمكن الحصول على مشتقات البولة المستبدلة عند N إما بتفاعل الأمينات الأولية وإما الثانوية مع الفوسجين:
تتبلورالبولة على هيئة بلورات موشورية بيضاء تنصهر عند الدرجة 132.7 ْس وهي جيدة الذوبان في الماء والإيتانول. والبولة أساس أحادي الوظيفة وتكوّن أملاحاً مع بعض الحموض، فعلى سبيل المثال: مع حمض كلور الماء HCl تكوِّن  .
.
إن أكسالات البولة ونتراتها رديئتا الذوبان في الماء. يؤدي تسخين البولة بوجود الحموض أو الأسس إلى حلمهتها إلى كربونات الأمونيوم، ويجري هذا التفاعل إنزيميا (بوجود إنزيم أورياز) في الشروط الفزيولوجية العادية.
عند تسخين البولة ببطء حتى الدرجة 150 ْـ160 ْس تفقد النشا در معطية البيوريت (ينصهر عند الدرجة 193 ْس).
يعطي البيوريت مع أيونات Cu في محاليل قلوية معقداً بنفسجياً (تفاعل البيوريت) يستخدم في الكشف الكيفي عن البولة.
إذا عولجت البولة بحمض الآزوتي يتكوَّن الآزوتُ إلى جانب الماء وثنائي أكسيد الكربون. يفيد قياس الآزوت المنطلق في تعيين مقدار البولة كمياً.
ويؤدي تفاعل البولة مع تحت الحموض الهالوجينية ( هيبوبروميت الصوديوم، على سبيل المثال) إلى تشكل الآزوت:
8 ـ السيان أميد NH2-C≡N
يمكن عدّه نتريلاً لحمض الكرباميك أو أميداً لحمض سيان الماء[ر] HCN أو بلا ماء البولة 0 ويمكن تحضيره إما بتفاعل البولة مع كلوريد التيونيل
وإما انطلاقاً من سيان أميد الكلسيوم الذي يحضر بدوره بتفاعل كربيد الكلسيوم مع الآ زوت عندالدرجة 1000ـ1100س.
يستخدم المزيج المتكون من سيا ن أميد الكلسيوم وهباب الفحم مباشرة سماداً.
يتحول سيان أميد بسهولة إلى البولة أو تيو البولة S=C(NH2)2 أو الغوانيدين بمعالجته بحمض الكبريت الممدد أو H2S أو NH3، على الترتيب.
ويتبلمر سيان أميد عند درجا ت حرارة أعلى من درجة انصهاره متحولاً إلى ثنائي سيان أميد الذي يتحول مع استمرار التسخين إلى الميلامين (الفورمايكا).
9 ـ الغوانيدين HN=C(NH2)2 guanidine
ويعد نظريا إيميدين حمض الكرباميك. ويحضر بتسخين سيان أميد مع كلوريد الأ مونيوم:
تنصهر بلورات الغوانيدين عند الدرجة 50 ْس. وهو يسلك سلوك أساس قوي أحادي الوظيفة. ويعزى ذلك إلى استقراره الطنيني، وهو يدخل في بنى بعض الأدوية. وهو يذوب في الماء والكحول.
10 ـ المشتقات الإيزوسيانية R-N=C=O
يمكن الحصول عليها بتفاعل حمض إيزوسيانيك isocyanic acid (أو حمض السيان) HNCO بهاليدات الألكيل أو كبريتات الألكيل.
تحضر الإيزوسيانات في الصناعة بتفاعل الأمينات الأولية مع الفوسجين ويتشكل المركب الوسطي كلوريد الكرباميد المستبدل عند N:
إيزوسيانات مواد سائلة ذات روائح حادة، وهي تتحول عند درجات الحرارة المرتفعة إلى تريميرات (بولميرات ثلاثية الحد) هي: 5,3,1 ـ ثلاثي ألكيل ـ5،3،1 ـ تري آزين تريون ـ6،4،2.
تستخدم إيزوسيانات في اصطناع ضروب اليوريتان المستبدلة عند N، ومشتقات البولة المستبدلة عند N. وفي الصناعة يمكن الحصول من ثنائي إيزوسيانات O=C=N(CH2)2N=C=O والديولات (الكحولات ثنائية الهدروكسيل) على بولميرات مهمة هي البولي يوريتانات.
11 ـ كلوريد السيانوجين Cl-C≡N:
يمكن عدّه كما لو كان بلاماء كلوريد الكرباميد أوكلوريد حمض سيان الماء HCN. يمكن الحصول عليه بسهولة بمعالجة سيانيد الصوديوم بالكلور:
وكلوريد السيانوجين غازسام ومسيل للدموع (يغلي عند الدرجة 12.6 ْس) وهو يتماثر بسهولة متحولا إلى 6,4,2 ـ ثلاثي كلور تري آزين ـ 5,3,1 (كلوريد حمض سيانوريك) الذي يتحلمه إلى حمض سيانوريك cyanuric acid الذي يعطي عند تسخينه حمض إيزوسيانيك
فاروق قنديل
Tetravalent functions - Fonctions quadrivalentes
الوظائف الرباعية التكافؤ
وظايف رباعيه تكافو
Tetravalent functions - Fonctions quadrivalentes
الوظائف الرباعية التكافؤ
الوظائف الرباعية التكافؤ tetravalent functions في الكيمياء هي وظائف عضوية يمكن عدّها مشتقة من الميتان. قد يرتبط الميتان بجذر X) X هو ذرة غير متجانسة أحادية التكافؤ)، وقد يرتبط بجذر Y) Y ذرة ثنائية التكافؤ أو ثلاثية التكافؤ)، وعلى هذا يمكن تقسيم هذه المركبات إلى أربعة أصناف:
CX4 X2C=Y Y=C=Y X−C≡N
عدد هذه المركبات كبير، ويوجز فيما يأتي أهمها:
1ـ ضروب رباعي هاليد الألكيل: CI4 , CBr4 , CCl4 , CF4 وأكثرها أهمية هو رباعي كلوريد الكربون. ويمكن الحصول عليه بمعالجة كبريت الكربون بـ S2Cl2:
 |
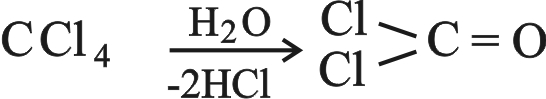 |
 |
يمكن الحصول عليها بمعالجة كلوروبيكرين ( نتروكلورفورم)
 |
 |
تتفاعل إسترات أورتو حمض الكربون مع الألدهيدات معطية الأستالات acetals ومع الكيتونات معطية الكيتالات ketals [ر: الكربونيلية (المشتقات ـ)] وكربونات ثنائية الألكيل (الإستر الثنائي لحمض الكربون).
 |
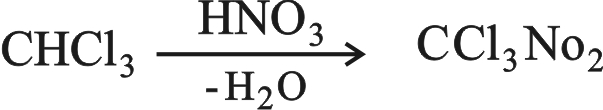
3 ـ الكلوروبكرين ( نتروكلوروفورم) CCl3NO2 chloropicrin
يمكن الحصول عليه بتفاعل الكلورفورم مع حمض الآزوت، وهو سام وله تأثير مبيد للحشرات:
 |
4 ـ الفوسجين (كلوريد الكربونيل) COCl2 phosgene
ويحضر بتفاعل أحادي أكسيد الكربون مع الكلور بوجود الضوء ( ديفي 1812). ويتم هذا التفاعل في الصناعة عند درجة حرارة تراوح بين 100ـ200 س بوجود الكربون الفعال حفّازاً (وسيطاً).
 |
 |
وبغض النظر عن خاصيته السمية فهو يستخدم في الصناعة، وفي اصطناع الكثير من المركبات العضوية. فيستخدم مثلاً في تفاعل فريدل ـ كرافتس مثل كلوريد الأسيتيل، وفي الحصول على إسترات كلورو حمض النمل ClCOOR.
 |
 |
5 ـ مشتقات حمض الكرباميك
لم يعرف حمض الكرباميك H2NCOOH في الحالة الحرة حتى اليوم. وكذلك فإن منتجات استبداله عند N التي تتكون على هيئة مركبات ثانوية ( في بعض إعادات الترتيب عند ذرة الآزوت) تفقد كربوكسيلها. أما أملاح حمض الكرباميك (الكربامات) فهي ثابتة، إذ يمكن اصطناع كربامات الأمونيوم بتفاعل الأمونيا مع CO2. تتحلمه كربامات الأمونيوم عند درجات عالية من الحرارة إلى كربونات الأمونيوم.
 |
هي إسترات حمض الكرباميك، ويمكن اصطناعها من إسترات كلوروحمض النمل، أو بمعالجة إسترات حمض الكربون بالنشادر (الأمونيا).
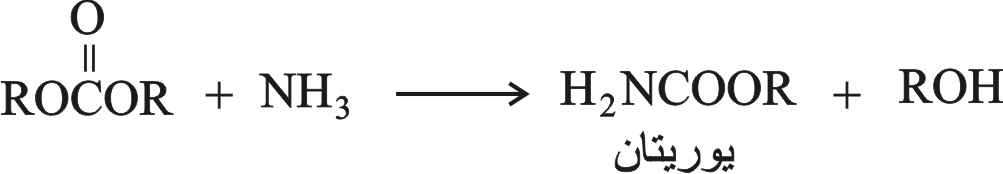 |
 |
7 ـ البولة (اليوريا) O=C(NH2)2
وتدعى أيضاً بالكرباميد، وهي من أهم منتجا ت استقلاب[ر] المواد الغذائية الحاوية الآزوت في الثديات. وقد عزلها الكيميائي الفرنسي رويل Hilaire - Martin Rouelle أول مرة عام 1772 من بول الإنسان.
والبولة أول مركب عضوي اصطنع من مواد لا عضوية. ففي عام 1928 بخر الكيميائي الألماني فوهلر Wohler محلولاً مائياً لسيانات البوتاسيوم وكبريتات الأمونيوم فحصل على سيانات الأمونيوم التي تماكبت معطية البولة.
وبقي لهذا التفاعل في الوقت الحاضر أهمية تاريخية فقط.
أما في الصناعة فتحضر البولة بالحلمهة الجزئية لسيان أميد، أو بتسخين كربامات الأمونيوم (الناتجة من معالجة CO2 بالأمونيا) عند درجة حرارة 120ـ150 ْس وتحت ضغط 25ـ40كغ/سم2، حيث تخضع لنزع مائها كلياً.
 |
 |
 .
.إن أكسالات البولة ونتراتها رديئتا الذوبان في الماء. يؤدي تسخين البولة بوجود الحموض أو الأسس إلى حلمهتها إلى كربونات الأمونيوم، ويجري هذا التفاعل إنزيميا (بوجود إنزيم أورياز) في الشروط الفزيولوجية العادية.
 |
 |
إذا عولجت البولة بحمض الآزوتي يتكوَّن الآزوتُ إلى جانب الماء وثنائي أكسيد الكربون. يفيد قياس الآزوت المنطلق في تعيين مقدار البولة كمياً.
 |
 |
يمكن عدّه نتريلاً لحمض الكرباميك أو أميداً لحمض سيان الماء[ر] HCN أو بلا ماء البولة 0 ويمكن تحضيره إما بتفاعل البولة مع كلوريد التيونيل
 |
 |
يتحول سيان أميد بسهولة إلى البولة أو تيو البولة S=C(NH2)2 أو الغوانيدين بمعالجته بحمض الكبريت الممدد أو H2S أو NH3، على الترتيب.
 |
 |
ويعد نظريا إيميدين حمض الكرباميك. ويحضر بتسخين سيان أميد مع كلوريد الأ مونيوم:
 |
10 ـ المشتقات الإيزوسيانية R-N=C=O
يمكن الحصول عليها بتفاعل حمض إيزوسيانيك isocyanic acid (أو حمض السيان) HNCO بهاليدات الألكيل أو كبريتات الألكيل.
 |
 |
 |
11 ـ كلوريد السيانوجين Cl-C≡N:
يمكن عدّه كما لو كان بلاماء كلوريد الكرباميد أوكلوريد حمض سيان الماء HCN. يمكن الحصول عليه بسهولة بمعالجة سيانيد الصوديوم بالكلور:
 |
 |
