تعدديه شكل
Polymorphism - Polymorphisme
تعددية الشكل
تعددية الشكل polymorphisme هي إحدى خواص المواد الصلبة التي لها تركيب كيمياوي متماثل، إلا أنها تختلف في خواصها البلورية، أي في الترتيب الهندسي للذرات، [ر.البلورات (علم ـ)].
ويُعرف الكثير من الأمثلة على تعددية الشكل، ففي عالم الفلزات mineraux يُصادف السيليس SiO2 في الحالة الطبيعية بعدة أشكال بلورية مثل الكوارتز والتريديميت tridymite والكريستوباليت cristobalite والكوينريت coeite، وتصادف كذلك كربونات الكلسيوم CaCO3 بعدة أشكال بلورية مثل الكلسيت، والأراغونيت aragonite والفاتيريت voterite. كما يتبلور أكسيد التيتانيوم TiO2 بشكل الروتيل rutile والأناتاز anatase، أو البروكيت brookite. ويوجد الكثير من الأمثلة الأخرى على الفلزات ذات الأشكال البلورية المتنوعة بما في ذلك الفلزات التي أمكن تحضيرها في المختبر.
إن البساطة في تعريف تعددية الشكل ظاهرية أكثر مما هي حقيقية، إذ تبين التحاليل أن وجود الشوائب بكميات قليلة، هو الذي يُسّهل عملية التبلور لأحد الأشكال البلورية، ومن جهة أخرى يصعب في كثير من الأحيان التفريق بين مفهوم تعددية الشكل ومفهوم التماكب isomerie الذي يتعلق بالمركبات الجزيئية التي لها التركيب الكيمياوي نفسه، ولكن تختلف فيما بينها بتوزع مكوناتها على الشكل الهندسي. وينتمي مفهوم التآصل allotropie، الذي أدخله برزليوس berzclius، إلى تعددية الشكل ولكنه أكثر تحديداً، لأنه لا يطبق إلا على المواد الكيمياوية فقط، وهو في الوقت نفسه أعم، لأنه يشمل كل الأشكال الصلبة التابعة لمادة كيمياوية متبلورة أو عديمة الشكل anorphes، وهي مركبات مؤلفة من جزئيات يمكن أن تختلف في طبيعتها، فبلورة الأكسجين مثلاً المؤلفة من جزئيات O2 في درجات الحرارة الشديدة الانخفاض، ليست متعددة الشكل ولكنها متآصلة لبلورة الأوزون المؤلفة من الجزئيات O3.
إن أول حالة تمت الإشارة إليها مثالاً على تعددية الشكل هي كربونات الكلسيوم. إذ لم يكن يميَّز الأراغونيت من الأباتيت (فسفات الكلسيوم Ca3(PO4)2 إلى أن تعرَّف العالم مارتان كلابروث Martin Klaproth عام (1788) أن تركيب الأراغونيت الكيمياوي هو تركيب الكلسيت. كذلك برهن إليهارد ميتشرليتس Eilhard Mitscherlich على أن الأجسام النقية كالكبريت S ويوديد الفضة AgI وفسفات الصوديوم Na3PO4، تأخذ أشكالاً بلورية مختلفة، فبدت تعددية الشكل حينئذٍ على أنها نتيجة للتبلور، إلا أنه تبين بعد ذلك إمكان التحول من شكل إلى آخر بالتسخين، وكان الظن غالباً بأن التحول transformation يتم أولاً في درجة حرارة محددة، وإن ظهرت بعض الاستثناءات. وقد بين متشرليتس أن الكبريت المعيني المستقيم orthothombique بلونه الأصفر الواضح في الدرجة العادية من الحرارة، يتحول بالتسخين إلى الكبريت الأحادي الميل monoclinique بلونه الأصفر البني. وفي عام 1884 بين ديزيريه جيرنيز Desire Gernez أن درجة حرارة تحول الكبريت هي 95.6 درجة سلزيوس، ومع ذلك يمكن الاحتفاظ بالكبريت المعيني المستقيم فوق هذه الدرجة من غير ملاحظة هذا التحول، فيكون الكبريت حينئذ في حالة شبه مستقرة metastable لفوق التسخين البلوري والتي ما تلبث أن تنقلب إذا جُعل الكبريت بتماس بلورة صغيرة أحادية الميل. وعلى العكس فإن الكبريت الأحادي الميل يمكن أن يبلغ حالة شبه مستقرة لفوق الانصهار البلوري بتبريده تحت الدرجة 95.6 درجة سلزيوس. وتتوقف هذه الحالة بتماس الكبريت مع كميات قليلة من بلورة معينية مستقيمة محضرة مسبقاً. وقد قاس جيرنيز سرعة التحول في درجة حرارة محددة تماماً، فتبين له أن الحدود بين حالتي الكبريت تلاحظ باختلاف اللون، وأن هذه السرعة معدومة في الدرجة 95.6 سلزيوس إذ يوجد الطوران معاً، وتزداد هذه السرعة بتناقص درجة الحرارة وتمر بنهاية عظمى ثم تتناقص إلى أن تنعدم في الدرجة 23 سلزيوس، وهي الدرجة التي دعاها جيرنيز بالدرجة الحيادية indifferente التي يصبح التهيج عندها ضعيفاً بدرجات الحرارة الأخفض. ويمكن للشكلين البلوريين أن يتكونا معاً دوماً. ويوضح الشكل (1) هذه الظاهرة.
أوضحت هذه النتائج وجود بعض المواد المتعددة الشكل polymorphes في درجة الحرارة نفسها والضغط ذاته، كالماس والغرافيت. ويُفسَّر التحول التعددي الشكل في درجة حرارة محددة على أنه انتقال متقطع للطورين المختلفين للمادة الصلبة، وهو يشبه تحول الحالة الصلبة إلى السائلة عند الانصهار. وقد بيِّن غوستاف تامان Gustav Tamman أن درجة حرارة التحول في حالة الكبريت خاصة، تتغير تبعاً للضغط، وميّز ليمان Lehmann المواد الثنائية الشكل enantiomorphes التي يكون التحول فيها عكوساً كما في الكبريت، من المواد التي تتصف بغياب العكوسية (كالماس أو الغرافيت بالتسخين)، ووضعت بسرعة مخططات التوازن بتابعية الحرارة والضغط لكثير من حالات تعددية الشكل.
الدراسة الترموديناميكية (التحريكية الحرارية)
حين تثبت الشروط من ضغط أو درجة حرارة، فإن أحد الأشكال المتعددة الشكل يكون ثابتاً أو مستقراً، في حين تكون الأشكال الأخرى غير ثابتة، ويبين الشكل (2) تشابه حالات التوازن هذه مع التوازنات الميكانيكية. فالحالة (2) في هذا الشكل مع كونها ثابتة، إلا أنها أقل ثباتاً من الحالة (1)، فيقال إن الحالة (2) تمر في مرحلة شبه ثابتة، ومن الضروري منح هذه الحالة قليلاً من طاقة التنشيط التي ترتبط بالتهيج الحراري لتحويلها إلى الحالة الثابتة (1).
ويُعرف من التحريك الحراري [ر] أن الطور الثابت هو الذي يتمتع بأخفض طاقة حرة F = E - T.S. إذا كانت متحولات الحالة هي درجة الحرارة المطلقة T والحجم، وحيث E يعبر عن الطاقة الداخلية وS عن الإنتروبية. وعندما T تساوي الصفر (الصفر المطلق(، فإن الطاقة الحرة تساوي الطاقة الداخلية (F = E)، ويتفق الشكل الثابت مع أخفض طاقة داخلية. ويغدو الحد T.S مهماً عند ارتفاع درجة الحرارة، ويمكن للحالة (2) ذات الطاقة الداخلية E2 والأعلى من E1، أن توجد فوق درجة التحول Tt لأن طاقتها الحرة F2 تصبح أصغر منF1. وهكذا فإن الانتقال من الشكل الثابت (1) في درجة الحرارة المنخفضة إلى الشكل الثابت في درجة الحرارة المرتفعة يمتص كمية من الطاقة DE = E2 - E1 تتفق مع الحرارة الكامنة اللاطية للتحول (أنظر الشكل 3) وإذا كان لأحد المركبات كثير من حالات تعددية الشكل فإن الطاقات الداخلية تكون مرتفعة في حالة الأطوار الثابتة بالدرجات المرتفعة من الحرارة كما يوضح ذلك الشكل (4). ويمكن لحرارة التحول اللاطية أن تستنتج من علاقة كلابيرون التي تربط بين فرق الحجم النوعي وبين الشكلين ومعدل تغير درجة حرارة التحول بتغير الضغط:
الخواص المميزة للأطوار شبه المستقرة
إن كل الأمثلة على الأطوار شبه المستقرة معروفة فلها جميعاً صفة مشتركة، وهي الانتقال إلى الطور المستقر بدرجة حرارة غير محددة، كما أن توتر بخارها tension أعلى من توتر بخار الأطوار الثابتة عند درجة الحرارة ذاتها، وكذلك فإنها أكثر انحلالاً في المذيب نفسه، ودرجة انصهارها أخفض. وينتج من هذا أن تبلور الأشكال شبه الثابتة، يحصل في المحاليل فوق المشبعة sursaturees إشباعاً فائقاً أو في السوائل فوق المنصهرة surfondus.
تعيين درجات حرارة التحول
هنالك عدة طرائق متبقية لتعيين درجات حرارة التحول مثل طريقة التحليل الحراري التفاضلي analyse thermique differentielle اختصاراً A.T.D، وهي تفيد في رسم منحني قياس إحدى الخصائص الفيزيائية بدلالة درجة الحرارة تحت ضغط ثابت أو بالعكس، ويُصاحب التحول عادة امتصاص متقطع للحرارة في أثناء التسخين، وانتشار للحرارة عند التبريد. إن طريقة التحليل الحراري تعطي درجة حرارة التحول مباشرة، بوضع المادة في فرن تتغير فيه درجة الحرارة كتابع خطي للزمن. ويستعمل لهذا الغرض جهاز التحليل التفاضلي وتسجل درجة حرارة المادة باستعمال مزدوجة كهر حرارية couples thermo-electriques إذ يقاس الفرق في درجة الحرارة بين المادة المدروسة وأحد الأجسام القياسية (العيارية) الخاملة ذات السعة الحرارية المعروفة مثل الألومين AL2O3. وهذه الطريقة حساسة جداً ولاتحتاج إلا إلى كميات صغيرة من المادة قيد الدرس (بصفة ميلي غرامات).
ومن الطرائق التي تكشف عن التمدد أو التقلص بدرجة حرارة التحول، طريقة قياس التمدد dilatométrique وتكون مقاييس التمدد التفاضلية حساسة جداً، وشائعة الاستعمال من قبل العاملين في حقل التعدين والسيراميك les metallurgistcset les céramistes.
أما الطريقة الضوئية methodes optiques التي تُظهر تغيراً في اللون أو تحولاً في الانكسار المضاعف birefringence أو في الاستطاعة الدورانية، فتكشف الكثير من حالات تعددية الشكل بفضل المجهر المقطب microscope polarisant المجهز بمنصة تسخين. وتُستعمل في هذا الجهاز كميات متناهية في الصغر من المادة المدروسة. إن التغير في اللون نادر الحدوث، والحالة الأولى التي أُشير إليها هي يوديد الزئبق الذي يكون رباعي quadratique أحمر اللون تحت الدرجة 3, 126 سلزيوس، ويغدو معينياً مستقيماً orthorhombique أصفر اللون فوق هذه الدرجة من الحرارة. وقد كشف هـ. لوشاتليه H.Lechatelier التحول التعددي الشكل من الكوارتز a إلى الكوارتز b عند الدرجة 573 سلزيوس بطريقة قياس التمدد.
وتطبق الطريقة الكهربائية على الأجسام الناقلة (المعادن والخلائط)، بأن ترسم منحني قابلية التوصيل الكهربائي بدلالة درجة الحرارة، كما تطبق الطريقة المغنطيسية الحرارية على المواد ذات المغنطيسية الحديدية ferromagnetique.
أخيراً هناك الطريقة التي تعتمد على أشعة X والمستعملة في البلورات بالتصوير الشعاعي [ر. البلورات في التصوير الشعاعي (دراسة ـ)] وهي أقل سرعة من الطرائق السابقة، ولكنها تعطي معلومات أكثر دقة عن التغيرات الحاصلة في الشبكات البلورية والتغيرات في ترتيب الذرات.
مخططات التوازن
كانت دراسة مجالات ثبات مختلف الأطوار الصلبة موضع اهتمام الباحثين منذ عام 1945، تستعمل في مجال الجيوفيزياء، للتعرف على حالات المادة التي تخضع لدرجات حرارة وضغوط مرتفعة. وأول رواد هذا الحقل كان العالم تامان Tammann في القرن الماضي، ويبدو عمله في المثال التقليدي لمخطط الكبريت الشكل (5) الذي يبين فيه أن ارتفاع الضغط إلى أكثر من 1440 كغ/سم2، يؤدي مباشرة إلى صهر الكبريت المعيني المستقيم عند درجة حرارة أعلى من 154 درجة سلزيوس. ثم وضع العالم الأمريكي ب. و. بردغمن P.W.Bridgman بين الحربين العالمتين، طرائق الضغوط المرتفعة، ومن إنجازاته المهمة في هذا المجال مخطط الماء الذي يبين مجالات ثبات ستة أشكال بلورية مختلفة من الجليد glacy.
ينصهر أحدهما بدرجة حرارة مرتفعة أعلى من 200 درجة سلزيوس عندما يقترب الضغط من 45000كغ/سم2. وقد أدت جملة أبحاث بردغمن إلى اصطناع الماس، ويوضح مخطط الشكل (6) الذي أعد تجريبياً بين 1500 و3000 درجة مطلقة أنه عندما يسخن الغرافيت حتى الدرجة 3000 عند ضغوط مرتفعة من رتبة 130 كيلو بار، يتحول إلى الماس في أقل من الثانية. وتطبق الصناعة ضغوطاً من 50 إلى 60 كيلو باراً ودرجات حرارة مرتفعة تراوح بين 1400 و1600 درجة سلزيوس باستخدام مذيب مناسب مثل مصهور النيكل.
تحولات التساند الثانوي
تهتم هذه التحولات بالمركبات غير المعدنية، ولاسيما في الكيمياء اللاعضوية. فعدد التساند، وهو عدد الذرات الأقرب إلى الذرة المتشردة (المتأينة)، يبقى على حاله، ولا تختلف الترتيبات البلورية إلا بالتوزع الثاني للذرات المجاورة، وبعبارة أخرى فإن متعددات الوجوه المؤلفة من الأيونات السالبة المحيطة بالأيونات الموجبة، ترتبط فيما بينها بصورة متبانية، وتتحول وفق إحدى آليتين تميزان تحولات الانتقال وتحولات إعادة التشكيل أو البناء reconstruetion.
ولا تؤدي تحولات الانتقال إلى قطع الروابط ما بين الذرات، ولكنها تشتمل على تشوهات في الشبكة البلورية. وغالباً ما يؤدي إلى تشكل بلورات توأمية.
يجب على تحول إعادة البناء أن تتجاوز حاجز الطاقة المرتفع، لأنه يتم بهدم إحدى الشبكات البلورية وذلك بإعادة ترتيبٍ مختلفٍ جداً لمتعدادت الوجوه نفسها. ويمكن أن يكون هذا التحول بطيئاً، في مرحلة شبه ثابتة، كما يمكن أن يدوم شكله في الأحقاب الجيولوجية.
تعددية الشكل وتغير التساند
يتغير عدد الذرات التي على تماس مع ذرة ما، كما في الحديد المكعب المركزي cubique centre، حيث تكون كل ذرة حديد على تماس مع ثماني ذرات أخرى. إذ يتحول إلى الحديد (بالدرجة 906 سلزيوس) ببنية مكعبة مركزية الوجوه cubique a’faces centrées، بعدد تساندي 12. ويكون كلوريد السيزيوم مكعباً في الدرجة العادية من الحرارة، وعدده التساندي 8 (حيث تحتل ذرة السيزيوم مركز الشبكة البلورية، وتحتل ذرات الكلور رؤوسها). وعند الدرجة 460 سلزيوس تتحول البنية الذرية إلى بنية كلوريد الصوديوم الموافقة للعدد التساندي 6. إن هذين التحولين سريعان، في حين تتم تحولات أخرى ببطء شديد كما هو حال كربونات الكلسيوم في الكلسيت (تكون كل شاردة كلسيوم Ca2+ على تماس مع ست ذرات أكسجين O2-). وفي الأراغونيت (تكون كل شاردة كلسيوم بتماس مع تسع ذرات أكسجين).
تغير نمط الرابطة
تتبلور بعض العناصر وفق شكلين بلوريين، أحدهما عازل تكون فيه الروابط من طبيعة مشتركة متماسكة، والآخر ناقل والروابط فيه من النوع المعدني، فالكربون يبدو في الماس (بتساند رباعي والروابط فيه قوية من النوع المشترك) وفي الغرافيت (بتساند ثلاثي والروابط فيه من النوع المعدني).
وتتكرر هذه الظاهرة في القصدير الأبيض والرمادي، يُضاف إلى ذلك أيضاً المركبات العضوية التي تتمتع فيها الجزيئات بروابط هدروجينية في الدرجات المنخفضة من الحرارة، في حين تكون الروابط فيها من نوع فاندرفالس في الدرجات المرتفعة من الحرارة.
التحولات النظامية والفوضوية
يتم في هذه التحولات دوران الجزيئات أو الشوارد المعقدة. إن هذا الدروان الناتج عن التهيج الحراري يزيد من التناظر في الجزيئات أو الشوارد المعقد، وهكذا فإن مركبات جزيئية مثل CH4, HI, HBr, HCL تكون متعددة الشكل، ويكون الشكل الصلب والثابت فيها قبل الانصهار تجمعاً مكتنزاً للكرات وهذا يعني أن هذه الجزيئات تتمتع داخل البلورة وبصورة إحصائية بتناظر كروي. ولنترات الأمونيوم NH4NO3 خمسة أشكال بلورية تحت الضغط العادي، فالشكل الموافق لدرجات الحرارة العالية والثابت بين 125 و168 سلزيوس (درجة انصهار النترات) يكون مكعباً مثل بنية كلوريد السيزيوم CsCl- (العدد التساندي 8). وهذا يعني أن شوارد النترات وشوارد الأمونيوم تتمتع بتناظر كروي بفعل الدوران.
إعادة الترتيب المنظم بعملية استبدال تحتل بعض الذرات، التي من طبيعة كيمياوية مختلفة، المواقع البلورية نفسها في الدرجات المرتفعة من الحرارة، ويتم ذلك بعملية انتشار diffusion حرارية، وهي متكافئة إحصائياً، ويكون التناظر أعظمياً، وفي درجة الحرارة المنخفضة تبدو هذه الذرات بترتيب منتظم وبتناظر أصغري. وتتكرر مثل هذه الحالة في التعدين، والمثال التقليدي على ذلك هو خليطة الذهب والنحاس AUCu3. ففي شكلها الفوضوي وفي الدرجات المرتفعة تحتل ذرات النحاس والذهب، بصورة عشوائية، مواقع الشبكة البلورية المكعبة مركزية الوجوه. أما في شكلها في درجة الحرارة المنخفضة، فإن ذرات الذهب تتنظم عند رؤوس المكعب، في حين تشغل ذرات النحاس مراكز وجوهه فقط، وتكون فوق البنية surstructure هذه ذات تناظر رباعي quadratique. يُلاحظ هذا النمط من تعددية الشكل في الألومينو سيليكات إذ تتوزع ذرات الألمينيوم Al والسيليسيوم Si في مراكز رباعيات وجوه منتظمة تشكل رؤوسها ذرات الأكسجين، وتصادف كذلك في الفلدسبات البوتاسي KAlSi3O8 وهو أحادي الميل في الشكل الفوضوي إذ تشكل ذرات السيليسيوم والألمينيوم عشوائياً مواقع رباعية الوجوه نفسها. كما يحدث ذلك أيضاً في السانيدين sanidine وهو فلز يحتوي على أحد أنواع الفلدسبات الزجاجي، وهو من أصل بركاني، يتوضع على الصخور البركانية وتكون نسبة الصوديوم فيه أعلى من النسبة الموجودة في الأورتوز orthose. تتوزع ذرات السيليسيوم والألمينيوم على المواقع التي تميز الشكل المنتظم الموافق لدرجة الحرارة المنخفضة، ولبنية ثلاثية الميل، والذي يدعى ميكروكلين microcline. إن هذا الانتظام الذي يمكن قياسه، يسمح برسم المخطط التاريخي الحراري للصخور التي يوجد فيها الفلز.
عبد المجيد البلخي
Polymorphism - Polymorphisme
تعددية الشكل
تعددية الشكل polymorphisme هي إحدى خواص المواد الصلبة التي لها تركيب كيمياوي متماثل، إلا أنها تختلف في خواصها البلورية، أي في الترتيب الهندسي للذرات، [ر.البلورات (علم ـ)].
ويُعرف الكثير من الأمثلة على تعددية الشكل، ففي عالم الفلزات mineraux يُصادف السيليس SiO2 في الحالة الطبيعية بعدة أشكال بلورية مثل الكوارتز والتريديميت tridymite والكريستوباليت cristobalite والكوينريت coeite، وتصادف كذلك كربونات الكلسيوم CaCO3 بعدة أشكال بلورية مثل الكلسيت، والأراغونيت aragonite والفاتيريت voterite. كما يتبلور أكسيد التيتانيوم TiO2 بشكل الروتيل rutile والأناتاز anatase، أو البروكيت brookite. ويوجد الكثير من الأمثلة الأخرى على الفلزات ذات الأشكال البلورية المتنوعة بما في ذلك الفلزات التي أمكن تحضيرها في المختبر.
إن البساطة في تعريف تعددية الشكل ظاهرية أكثر مما هي حقيقية، إذ تبين التحاليل أن وجود الشوائب بكميات قليلة، هو الذي يُسّهل عملية التبلور لأحد الأشكال البلورية، ومن جهة أخرى يصعب في كثير من الأحيان التفريق بين مفهوم تعددية الشكل ومفهوم التماكب isomerie الذي يتعلق بالمركبات الجزيئية التي لها التركيب الكيمياوي نفسه، ولكن تختلف فيما بينها بتوزع مكوناتها على الشكل الهندسي. وينتمي مفهوم التآصل allotropie، الذي أدخله برزليوس berzclius، إلى تعددية الشكل ولكنه أكثر تحديداً، لأنه لا يطبق إلا على المواد الكيمياوية فقط، وهو في الوقت نفسه أعم، لأنه يشمل كل الأشكال الصلبة التابعة لمادة كيمياوية متبلورة أو عديمة الشكل anorphes، وهي مركبات مؤلفة من جزئيات يمكن أن تختلف في طبيعتها، فبلورة الأكسجين مثلاً المؤلفة من جزئيات O2 في درجات الحرارة الشديدة الانخفاض، ليست متعددة الشكل ولكنها متآصلة لبلورة الأوزون المؤلفة من الجزئيات O3.
 |
أوضحت هذه النتائج وجود بعض المواد المتعددة الشكل polymorphes في درجة الحرارة نفسها والضغط ذاته، كالماس والغرافيت. ويُفسَّر التحول التعددي الشكل في درجة حرارة محددة على أنه انتقال متقطع للطورين المختلفين للمادة الصلبة، وهو يشبه تحول الحالة الصلبة إلى السائلة عند الانصهار. وقد بيِّن غوستاف تامان Gustav Tamman أن درجة حرارة التحول في حالة الكبريت خاصة، تتغير تبعاً للضغط، وميّز ليمان Lehmann المواد الثنائية الشكل enantiomorphes التي يكون التحول فيها عكوساً كما في الكبريت، من المواد التي تتصف بغياب العكوسية (كالماس أو الغرافيت بالتسخين)، ووضعت بسرعة مخططات التوازن بتابعية الحرارة والضغط لكثير من حالات تعددية الشكل.
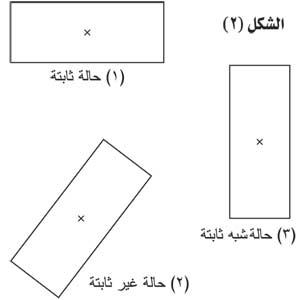 |
حين تثبت الشروط من ضغط أو درجة حرارة، فإن أحد الأشكال المتعددة الشكل يكون ثابتاً أو مستقراً، في حين تكون الأشكال الأخرى غير ثابتة، ويبين الشكل (2) تشابه حالات التوازن هذه مع التوازنات الميكانيكية. فالحالة (2) في هذا الشكل مع كونها ثابتة، إلا أنها أقل ثباتاً من الحالة (1)، فيقال إن الحالة (2) تمر في مرحلة شبه ثابتة، ومن الضروري منح هذه الحالة قليلاً من طاقة التنشيط التي ترتبط بالتهيج الحراري لتحويلها إلى الحالة الثابتة (1).
ويُعرف من التحريك الحراري [ر] أن الطور الثابت هو الذي يتمتع بأخفض طاقة حرة F = E - T.S. إذا كانت متحولات الحالة هي درجة الحرارة المطلقة T والحجم، وحيث E يعبر عن الطاقة الداخلية وS عن الإنتروبية. وعندما T تساوي الصفر (الصفر المطلق(، فإن الطاقة الحرة تساوي الطاقة الداخلية (F = E)، ويتفق الشكل الثابت مع أخفض طاقة داخلية. ويغدو الحد T.S مهماً عند ارتفاع درجة الحرارة، ويمكن للحالة (2) ذات الطاقة الداخلية E2 والأعلى من E1، أن توجد فوق درجة التحول Tt لأن طاقتها الحرة F2 تصبح أصغر منF1. وهكذا فإن الانتقال من الشكل الثابت (1) في درجة الحرارة المنخفضة إلى الشكل الثابت في درجة الحرارة المرتفعة يمتص كمية من الطاقة DE = E2 - E1 تتفق مع الحرارة الكامنة اللاطية للتحول (أنظر الشكل 3) وإذا كان لأحد المركبات كثير من حالات تعددية الشكل فإن الطاقات الداخلية تكون مرتفعة في حالة الأطوار الثابتة بالدرجات المرتفعة من الحرارة كما يوضح ذلك الشكل (4). ويمكن لحرارة التحول اللاطية أن تستنتج من علاقة كلابيرون التي تربط بين فرق الحجم النوعي وبين الشكلين ومعدل تغير درجة حرارة التحول بتغير الضغط:
 |
إن كل الأمثلة على الأطوار شبه المستقرة معروفة فلها جميعاً صفة مشتركة، وهي الانتقال إلى الطور المستقر بدرجة حرارة غير محددة، كما أن توتر بخارها tension أعلى من توتر بخار الأطوار الثابتة عند درجة الحرارة ذاتها، وكذلك فإنها أكثر انحلالاً في المذيب نفسه، ودرجة انصهارها أخفض. وينتج من هذا أن تبلور الأشكال شبه الثابتة، يحصل في المحاليل فوق المشبعة sursaturees إشباعاً فائقاً أو في السوائل فوق المنصهرة surfondus.
تعيين درجات حرارة التحول
 |
ومن الطرائق التي تكشف عن التمدد أو التقلص بدرجة حرارة التحول، طريقة قياس التمدد dilatométrique وتكون مقاييس التمدد التفاضلية حساسة جداً، وشائعة الاستعمال من قبل العاملين في حقل التعدين والسيراميك les metallurgistcset les céramistes.
أما الطريقة الضوئية methodes optiques التي تُظهر تغيراً في اللون أو تحولاً في الانكسار المضاعف birefringence أو في الاستطاعة الدورانية، فتكشف الكثير من حالات تعددية الشكل بفضل المجهر المقطب microscope polarisant المجهز بمنصة تسخين. وتُستعمل في هذا الجهاز كميات متناهية في الصغر من المادة المدروسة. إن التغير في اللون نادر الحدوث، والحالة الأولى التي أُشير إليها هي يوديد الزئبق الذي يكون رباعي quadratique أحمر اللون تحت الدرجة 3, 126 سلزيوس، ويغدو معينياً مستقيماً orthorhombique أصفر اللون فوق هذه الدرجة من الحرارة. وقد كشف هـ. لوشاتليه H.Lechatelier التحول التعددي الشكل من الكوارتز a إلى الكوارتز b عند الدرجة 573 سلزيوس بطريقة قياس التمدد.
وتطبق الطريقة الكهربائية على الأجسام الناقلة (المعادن والخلائط)، بأن ترسم منحني قابلية التوصيل الكهربائي بدلالة درجة الحرارة، كما تطبق الطريقة المغنطيسية الحرارية على المواد ذات المغنطيسية الحديدية ferromagnetique.
 |
مخططات التوازن
كانت دراسة مجالات ثبات مختلف الأطوار الصلبة موضع اهتمام الباحثين منذ عام 1945، تستعمل في مجال الجيوفيزياء، للتعرف على حالات المادة التي تخضع لدرجات حرارة وضغوط مرتفعة. وأول رواد هذا الحقل كان العالم تامان Tammann في القرن الماضي، ويبدو عمله في المثال التقليدي لمخطط الكبريت الشكل (5) الذي يبين فيه أن ارتفاع الضغط إلى أكثر من 1440 كغ/سم2، يؤدي مباشرة إلى صهر الكبريت المعيني المستقيم عند درجة حرارة أعلى من 154 درجة سلزيوس. ثم وضع العالم الأمريكي ب. و. بردغمن P.W.Bridgman بين الحربين العالمتين، طرائق الضغوط المرتفعة، ومن إنجازاته المهمة في هذا المجال مخطط الماء الذي يبين مجالات ثبات ستة أشكال بلورية مختلفة من الجليد glacy.
 |
تحولات التساند الثانوي
تهتم هذه التحولات بالمركبات غير المعدنية، ولاسيما في الكيمياء اللاعضوية. فعدد التساند، وهو عدد الذرات الأقرب إلى الذرة المتشردة (المتأينة)، يبقى على حاله، ولا تختلف الترتيبات البلورية إلا بالتوزع الثاني للذرات المجاورة، وبعبارة أخرى فإن متعددات الوجوه المؤلفة من الأيونات السالبة المحيطة بالأيونات الموجبة، ترتبط فيما بينها بصورة متبانية، وتتحول وفق إحدى آليتين تميزان تحولات الانتقال وتحولات إعادة التشكيل أو البناء reconstruetion.
ولا تؤدي تحولات الانتقال إلى قطع الروابط ما بين الذرات، ولكنها تشتمل على تشوهات في الشبكة البلورية. وغالباً ما يؤدي إلى تشكل بلورات توأمية.
يجب على تحول إعادة البناء أن تتجاوز حاجز الطاقة المرتفع، لأنه يتم بهدم إحدى الشبكات البلورية وذلك بإعادة ترتيبٍ مختلفٍ جداً لمتعدادت الوجوه نفسها. ويمكن أن يكون هذا التحول بطيئاً، في مرحلة شبه ثابتة، كما يمكن أن يدوم شكله في الأحقاب الجيولوجية.
تعددية الشكل وتغير التساند
يتغير عدد الذرات التي على تماس مع ذرة ما، كما في الحديد المكعب المركزي cubique centre، حيث تكون كل ذرة حديد على تماس مع ثماني ذرات أخرى. إذ يتحول إلى الحديد (بالدرجة 906 سلزيوس) ببنية مكعبة مركزية الوجوه cubique a’faces centrées، بعدد تساندي 12. ويكون كلوريد السيزيوم مكعباً في الدرجة العادية من الحرارة، وعدده التساندي 8 (حيث تحتل ذرة السيزيوم مركز الشبكة البلورية، وتحتل ذرات الكلور رؤوسها). وعند الدرجة 460 سلزيوس تتحول البنية الذرية إلى بنية كلوريد الصوديوم الموافقة للعدد التساندي 6. إن هذين التحولين سريعان، في حين تتم تحولات أخرى ببطء شديد كما هو حال كربونات الكلسيوم في الكلسيت (تكون كل شاردة كلسيوم Ca2+ على تماس مع ست ذرات أكسجين O2-). وفي الأراغونيت (تكون كل شاردة كلسيوم بتماس مع تسع ذرات أكسجين).
تغير نمط الرابطة
تتبلور بعض العناصر وفق شكلين بلوريين، أحدهما عازل تكون فيه الروابط من طبيعة مشتركة متماسكة، والآخر ناقل والروابط فيه من النوع المعدني، فالكربون يبدو في الماس (بتساند رباعي والروابط فيه قوية من النوع المشترك) وفي الغرافيت (بتساند ثلاثي والروابط فيه من النوع المعدني).
وتتكرر هذه الظاهرة في القصدير الأبيض والرمادي، يُضاف إلى ذلك أيضاً المركبات العضوية التي تتمتع فيها الجزيئات بروابط هدروجينية في الدرجات المنخفضة من الحرارة، في حين تكون الروابط فيها من نوع فاندرفالس في الدرجات المرتفعة من الحرارة.
التحولات النظامية والفوضوية
يتم في هذه التحولات دوران الجزيئات أو الشوارد المعقدة. إن هذا الدروان الناتج عن التهيج الحراري يزيد من التناظر في الجزيئات أو الشوارد المعقد، وهكذا فإن مركبات جزيئية مثل CH4, HI, HBr, HCL تكون متعددة الشكل، ويكون الشكل الصلب والثابت فيها قبل الانصهار تجمعاً مكتنزاً للكرات وهذا يعني أن هذه الجزيئات تتمتع داخل البلورة وبصورة إحصائية بتناظر كروي. ولنترات الأمونيوم NH4NO3 خمسة أشكال بلورية تحت الضغط العادي، فالشكل الموافق لدرجات الحرارة العالية والثابت بين 125 و168 سلزيوس (درجة انصهار النترات) يكون مكعباً مثل بنية كلوريد السيزيوم CsCl- (العدد التساندي 8). وهذا يعني أن شوارد النترات وشوارد الأمونيوم تتمتع بتناظر كروي بفعل الدوران.
إعادة الترتيب المنظم بعملية استبدال تحتل بعض الذرات، التي من طبيعة كيمياوية مختلفة، المواقع البلورية نفسها في الدرجات المرتفعة من الحرارة، ويتم ذلك بعملية انتشار diffusion حرارية، وهي متكافئة إحصائياً، ويكون التناظر أعظمياً، وفي درجة الحرارة المنخفضة تبدو هذه الذرات بترتيب منتظم وبتناظر أصغري. وتتكرر مثل هذه الحالة في التعدين، والمثال التقليدي على ذلك هو خليطة الذهب والنحاس AUCu3. ففي شكلها الفوضوي وفي الدرجات المرتفعة تحتل ذرات النحاس والذهب، بصورة عشوائية، مواقع الشبكة البلورية المكعبة مركزية الوجوه. أما في شكلها في درجة الحرارة المنخفضة، فإن ذرات الذهب تتنظم عند رؤوس المكعب، في حين تشغل ذرات النحاس مراكز وجوهه فقط، وتكون فوق البنية surstructure هذه ذات تناظر رباعي quadratique. يُلاحظ هذا النمط من تعددية الشكل في الألومينو سيليكات إذ تتوزع ذرات الألمينيوم Al والسيليسيوم Si في مراكز رباعيات وجوه منتظمة تشكل رؤوسها ذرات الأكسجين، وتصادف كذلك في الفلدسبات البوتاسي KAlSi3O8 وهو أحادي الميل في الشكل الفوضوي إذ تشكل ذرات السيليسيوم والألمينيوم عشوائياً مواقع رباعية الوجوه نفسها. كما يحدث ذلك أيضاً في السانيدين sanidine وهو فلز يحتوي على أحد أنواع الفلدسبات الزجاجي، وهو من أصل بركاني، يتوضع على الصخور البركانية وتكون نسبة الصوديوم فيه أعلى من النسبة الموجودة في الأورتوز orthose. تتوزع ذرات السيليسيوم والألمينيوم على المواقع التي تميز الشكل المنتظم الموافق لدرجة الحرارة المنخفضة، ولبنية ثلاثية الميل، والذي يدعى ميكروكلين microcline. إن هذا الانتظام الذي يمكن قياسه، يسمح برسم المخطط التاريخي الحراري للصخور التي يوجد فيها الفلز.
عبد المجيد البلخي
