خواص الذرّات
العدد الذرّي:
وهو يبين لنا عدد البروتونات التي تحتوي عليها الذرة. فعلى سبيل المثال، تحتوي كل ذرة هيدروجين على بروتون واحد، ولهذا، فإن العدد الذرّي للهيدروجين 1. ويتدرج العدد الذري للعناصر الطبيعية الأخرى تصاعديا حتى يصل إلى 92 لليورانيوم، الذي يحتوي على 92 بروتونًا في كل ذرة من ذراته. وتتكون كذلك كميات ضئيلة من البلوتونيوم، الذي يبلغ عدده الذري 94، بصورة طبيعية. ويمكن إيجاد العناصر التي يزيد عددها الذري على 92 في المختبر.
يحدد العدد الذري ترتيب العنصر في الجدول الدوري. وينظم هذا الجدول العناصر المختلفة في مجموعات تتشابه في خواصها الكيميائية. للاطلاع على هذا الجدول ★ تَصَفح: العنصر الكيميائي.
العدد الكتلي:
هو حاصل جمع عدد البروتونات وعدد النيوترونات في ذرة. وبالرغم من أن كل الذرات في عنصر ما لها نفس عدد البروتونات، إلا أنها قد تختلف في عدد النيوترونات. ويطلق على الذرات التي لها نفس عدد البروتونات وتختلف في عدد النيوترونات اسم النظائر.
وأغلب العناصر الموجودة في الطبيعة لها أكثر من نظير فالهيدروجين، على سبيل المثال، له ثلاثة نظائر. وتتكون النواة في أكثر نظائر الهيدروجين شيوعًا من بروتون واحد فقط. بينما تتكون النواة في النظيرين الآخرين من نيوترون واحد أو نيوترونين بالإضافة إلى البروتون. ويستخدم العلماء العدد الكتلي للتمييز بين نظائر الهيدروجين الثلاثة لتصبح هيدروجين 1، هيدروجين 2، هيدروجين 3. كما يُسمون الهيدروجين 1 بروتيوم، وهيدروجين 2 ديوتريوم، وهيدروجين 3 ترِيتْيوم.
وفي أغلب العناصر الأخف، تحتوي نواة كل ذرّة علي عدد متساوٍ من البروتونات والنيوترونات. بينما تحتوي نوى العناصر الأثقل على عدد من النيوترونات أكبر من عدد البروتونات. أما أثقل العناصر فبها نحو ثلاثة نيوترونات لكل اثنين من البروتونات. فاليورانيوم 238، مثلاً، به 146 نيوترونًا مقابل 92 بروتونًا في كل ذرة.
الوزن الذري:
هو وزن الذرّة معبَّرًا عنه بوحدات الكتلة الذرية. وتعادل وحدة الكتلة الذرية التي تُسمى أحيانًا دالتون 1/12 من وزن ذرة الكربون 12. ويكون الوزن الذرّي لأغلب الذرات مُعَبَّرًا عنه بالدالتون قريبًا جدًا من العدد الكتلي. ووحدات الكتلة الذرية بالغة الصغر فهناك 602 بليون ترِليون دالتون في كل جرام.
ويُعيِّن العلماء الوزن الذري لعنصر متعدد النظائر بإيجاد متوسط الأوزان الذرية لهذه النظائر بنسب وجودها في الطبيعة. فيبلغ الوزن الذري لغاز الكلور، على سبيل المثال، 35,453 دالتون. وهذه القيمة هي متوسط الوزن الذري للنظيرين كلور 35 (وزنه الذري 34,96885) وكلور 37 (وزنه الذري 36,96590) حسب نسبة كل منهما في الطبيعة.
الشحنة الكهربائية:
رغم أن الذرة تكون عادة متعادلة كهربائيًا، إلا أنها قد تفقد أو تكتسب قليلاً من الإلكترونات في بعض التفاعلات الكيميائية أو عند اصطدامها بإلكترون أو بذرّة أخرى. وينتج عن هذا الفقد أو الاكتساب ذرة مشحونة كهربائيًا تُسمَّى بالأيون، وتصبح الذرة التي فقدت إلكترونات أيونًا موجبًا بينما تصبح الذرة التي اكتسبت إلكترونات أيونًا سالبًا. وتُسمَّى عملية الفقد أو الاكتساب هذه التأين.
السلوك الكيميائي:
يتحدد السلوك الكيميائي لذرة ما إلى حد بعيد بعدد الإلكترونات الموجودة في مدارها الخارجي. وعندما تتجمع الذرات لتكوِّن جزيئات، فإن الإلكترونات في المدارات الخارجية إما أن تنتقل من ذرة إلى أخرى أو تشارك فيها الذرات المختلفة. ويُعبَّر عن عدد الإلكترونات الداخلة في هذه العملية بالتكافؤ. ولذرات بعض العناصر أكثر من تكافؤ. ويعتمد ذلك على عدد ونوع الذرات التي سيتم التفاعل معها.
ويكون تكافؤ الذرة موجبًا إذا كانت تميل لفقد إلكترونات لذرات أخرى. بينما يكون التكافؤ سالبًا إذا مالت الذرة إلى اكتساب إلكترونات من ذرات أخرى. فالصوديوم، على سبيل المثال، يميل لفقد إلكترون واحد وهكذا يصبح تكافؤه + 1. أما الكلور، فيميل لاكتساب إلكترون واحد وبهذا يصبح تكافؤه - 1.
ويتكون جزيء ملح المائدة العادي من ذرة صوديوم واحدة مرتبطة بذرة كلور واحدة. وتعطي ذرة الصوديوم الإلكترون الذي تكتسبه ذرة الكلور.
النشاط الإشعاعي:
تستطيع النواة في بعض الذرّات أن تتغير بصورة طبيعية. وتُسمَّى مثل هذه الذرات نشطة إشعاعيًا. وقد يكون التَغيُّر في النواة قاصرًا فقط على تغير في ترتيب البروتونات والنيوترونات. وفي حالات أخرى، يتغير العدد الفعلي للبروتونات والنيوترونات. وعندما تتغير نواة فإنها تعطي إشعاعًا. ويتكون هذا الإشعاع من جُسَيمْات ألفا أو جُسيمات بيتا أو أشعة جاما. وذرات اليورانيوم والراديوم وكل العناصر الأخرى الأثقل من البزموت نشطة إشعاعيًا. كذلك، لبعض نظائر العناصر الأخف كالكربون نشاط إشعاعي. وبالإضافة إلى ذلك، يستطيع علماء الطبيعة تكوين نظائر مشعة لكل العناصر تقريبًا في المختبر وذلك بإطلاق بروتونات أو نيوترونات أو جُسَيمات تحت ذرية على ذرات هذه العناصر .
ويعتمد نوع الإشعاع المنبعث من نواة نشيطة إشعاعيًا على طريقة تغيُّر النواة. فتنبعث أشعة جاما عندما يتغير فقط ترتيب البروتونات والنيوترونات في النواة. بينما تنبعث أشعة ألفا وبيتا عندما يتغير عدد البروتونات والنيوترونات في النواة، وتصبح الذرة حينئذ ذرة عنصر مغاير. تُسمَّى هذه العملية بتحول العناصر أو الانحلال الإشعاعي. ★ تَصَفح: النشاط الإشعاعي ؛ تحول العناصر.
العدد الذرّي:
وهو يبين لنا عدد البروتونات التي تحتوي عليها الذرة. فعلى سبيل المثال، تحتوي كل ذرة هيدروجين على بروتون واحد، ولهذا، فإن العدد الذرّي للهيدروجين 1. ويتدرج العدد الذري للعناصر الطبيعية الأخرى تصاعديا حتى يصل إلى 92 لليورانيوم، الذي يحتوي على 92 بروتونًا في كل ذرة من ذراته. وتتكون كذلك كميات ضئيلة من البلوتونيوم، الذي يبلغ عدده الذري 94، بصورة طبيعية. ويمكن إيجاد العناصر التي يزيد عددها الذري على 92 في المختبر.
يحدد العدد الذري ترتيب العنصر في الجدول الدوري. وينظم هذا الجدول العناصر المختلفة في مجموعات تتشابه في خواصها الكيميائية. للاطلاع على هذا الجدول ★ تَصَفح: العنصر الكيميائي.
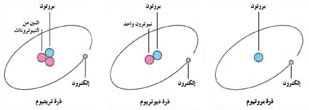 |
| نظائر الهيدروجين. النظائر هي ذرات لنفس العنصر لها أعداد مختلفة من النيوترونات. وللهيدروجين، على سبيل المثال، ثلاثة نظائر. البروتيوم وهو أكثر نظائر الهيدروجين شيوعًا، وتحتوي نواته على بروتون واحد. والديوتريوم تحتوي نواته على بروتون واحد ونيوترون واحد بينما تحتوي نواة النظير الثالث للهيدروجين وهو التريتيوم على بروتون واحد واثنين من النيوترونات. |
هو حاصل جمع عدد البروتونات وعدد النيوترونات في ذرة. وبالرغم من أن كل الذرات في عنصر ما لها نفس عدد البروتونات، إلا أنها قد تختلف في عدد النيوترونات. ويطلق على الذرات التي لها نفس عدد البروتونات وتختلف في عدد النيوترونات اسم النظائر.
وأغلب العناصر الموجودة في الطبيعة لها أكثر من نظير فالهيدروجين، على سبيل المثال، له ثلاثة نظائر. وتتكون النواة في أكثر نظائر الهيدروجين شيوعًا من بروتون واحد فقط. بينما تتكون النواة في النظيرين الآخرين من نيوترون واحد أو نيوترونين بالإضافة إلى البروتون. ويستخدم العلماء العدد الكتلي للتمييز بين نظائر الهيدروجين الثلاثة لتصبح هيدروجين 1، هيدروجين 2، هيدروجين 3. كما يُسمون الهيدروجين 1 بروتيوم، وهيدروجين 2 ديوتريوم، وهيدروجين 3 ترِيتْيوم.
وفي أغلب العناصر الأخف، تحتوي نواة كل ذرّة علي عدد متساوٍ من البروتونات والنيوترونات. بينما تحتوي نوى العناصر الأثقل على عدد من النيوترونات أكبر من عدد البروتونات. أما أثقل العناصر فبها نحو ثلاثة نيوترونات لكل اثنين من البروتونات. فاليورانيوم 238، مثلاً، به 146 نيوترونًا مقابل 92 بروتونًا في كل ذرة.
الوزن الذري:
هو وزن الذرّة معبَّرًا عنه بوحدات الكتلة الذرية. وتعادل وحدة الكتلة الذرية التي تُسمى أحيانًا دالتون 1/12 من وزن ذرة الكربون 12. ويكون الوزن الذرّي لأغلب الذرات مُعَبَّرًا عنه بالدالتون قريبًا جدًا من العدد الكتلي. ووحدات الكتلة الذرية بالغة الصغر فهناك 602 بليون ترِليون دالتون في كل جرام.
ويُعيِّن العلماء الوزن الذري لعنصر متعدد النظائر بإيجاد متوسط الأوزان الذرية لهذه النظائر بنسب وجودها في الطبيعة. فيبلغ الوزن الذري لغاز الكلور، على سبيل المثال، 35,453 دالتون. وهذه القيمة هي متوسط الوزن الذري للنظيرين كلور 35 (وزنه الذري 34,96885) وكلور 37 (وزنه الذري 36,96590) حسب نسبة كل منهما في الطبيعة.
الشحنة الكهربائية:
رغم أن الذرة تكون عادة متعادلة كهربائيًا، إلا أنها قد تفقد أو تكتسب قليلاً من الإلكترونات في بعض التفاعلات الكيميائية أو عند اصطدامها بإلكترون أو بذرّة أخرى. وينتج عن هذا الفقد أو الاكتساب ذرة مشحونة كهربائيًا تُسمَّى بالأيون، وتصبح الذرة التي فقدت إلكترونات أيونًا موجبًا بينما تصبح الذرة التي اكتسبت إلكترونات أيونًا سالبًا. وتُسمَّى عملية الفقد أو الاكتساب هذه التأين.
السلوك الكيميائي:
يتحدد السلوك الكيميائي لذرة ما إلى حد بعيد بعدد الإلكترونات الموجودة في مدارها الخارجي. وعندما تتجمع الذرات لتكوِّن جزيئات، فإن الإلكترونات في المدارات الخارجية إما أن تنتقل من ذرة إلى أخرى أو تشارك فيها الذرات المختلفة. ويُعبَّر عن عدد الإلكترونات الداخلة في هذه العملية بالتكافؤ. ولذرات بعض العناصر أكثر من تكافؤ. ويعتمد ذلك على عدد ونوع الذرات التي سيتم التفاعل معها.
ويكون تكافؤ الذرة موجبًا إذا كانت تميل لفقد إلكترونات لذرات أخرى. بينما يكون التكافؤ سالبًا إذا مالت الذرة إلى اكتساب إلكترونات من ذرات أخرى. فالصوديوم، على سبيل المثال، يميل لفقد إلكترون واحد وهكذا يصبح تكافؤه + 1. أما الكلور، فيميل لاكتساب إلكترون واحد وبهذا يصبح تكافؤه - 1.
ويتكون جزيء ملح المائدة العادي من ذرة صوديوم واحدة مرتبطة بذرة كلور واحدة. وتعطي ذرة الصوديوم الإلكترون الذي تكتسبه ذرة الكلور.
النشاط الإشعاعي:
تستطيع النواة في بعض الذرّات أن تتغير بصورة طبيعية. وتُسمَّى مثل هذه الذرات نشطة إشعاعيًا. وقد يكون التَغيُّر في النواة قاصرًا فقط على تغير في ترتيب البروتونات والنيوترونات. وفي حالات أخرى، يتغير العدد الفعلي للبروتونات والنيوترونات. وعندما تتغير نواة فإنها تعطي إشعاعًا. ويتكون هذا الإشعاع من جُسَيمْات ألفا أو جُسيمات بيتا أو أشعة جاما. وذرات اليورانيوم والراديوم وكل العناصر الأخرى الأثقل من البزموت نشطة إشعاعيًا. كذلك، لبعض نظائر العناصر الأخف كالكربون نشاط إشعاعي. وبالإضافة إلى ذلك، يستطيع علماء الطبيعة تكوين نظائر مشعة لكل العناصر تقريبًا في المختبر وذلك بإطلاق بروتونات أو نيوترونات أو جُسَيمات تحت ذرية على ذرات هذه العناصر .
ويعتمد نوع الإشعاع المنبعث من نواة نشيطة إشعاعيًا على طريقة تغيُّر النواة. فتنبعث أشعة جاما عندما يتغير فقط ترتيب البروتونات والنيوترونات في النواة. بينما تنبعث أشعة ألفا وبيتا عندما يتغير عدد البروتونات والنيوترونات في النواة، وتصبح الذرة حينئذ ذرة عنصر مغاير. تُسمَّى هذه العملية بتحول العناصر أو الانحلال الإشعاعي. ★ تَصَفح: النشاط الإشعاعي ؛ تحول العناصر.
