ما هي تقنية كريسبر؟
كريسبر أداة للتعديل الجيني، تسمح للباحثين بأن يعدلوا تتاليات الحمض النووي الريبي منقوص الأوكسجين «دنا»، ومن ثم إحداث تغيير في وظيفة الجين.
للتقنية عدة تطبيقات، منها تصحيح الأخطاء الجينية، وعلاج الأمراض والوقاية من انتشارها، وتحسين نمو المحاصيل. ومع أنها تقنية واعدة، فإنها تثير العديد من المخاوف الأخلاقية.
مصطلح كريسبر (CRISPR) هو اختصار لـ (CRISPR-Cas9). كريسبر هو امتدادات من الدنا مع البروتين كاس9 (Cas9)، وهو إنزيم يعمل مقصًا جزيئيًا قادرًا على قطع سلاسل الدنا.
استمدت تقنية كريسبر من آليات الدفاع الطبيعية للبكتيريا والعتائق، وهي مجموعة من العضيات وحيدة الخلية تُسمى العضيات الميكروية. تستخدم هذه العضيات الحمض النووي الريبي «الرنا» المشتق من دنا كريسبر، والعديد من بروتينات كاس لتحبط هجوم الفيروسات. إذ تقطّع العضية الدنا الفيروسي وترتب أجزاء منه في جينومها لتستخدمه سلاحًا ضد الفيروسات الغازية حال هاجمت مجددًا.
عند نقل مكونات الكريسبر إلى عضية أخرى أعقد، ستتمكن هذه المكونات من التلاعب بالجينات، ما يُسمى التعديل الجيني.
المكونات الرئيسية لكريسبر
جزيئة دنا مضاعف الطاق، مكون من أزواج من الأسس: إما أدنين يقابله تايمين أو سيتوزين يقابله غوانين.
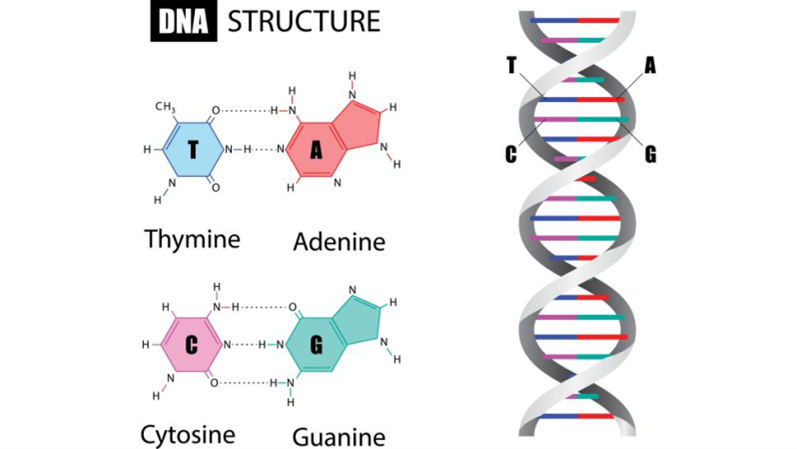
يعني مصطلح CRISPR: التكرارات العنقودية المتناظرة القصيرة منتظمة التباعد، ما يعني قطعة من الدنا مكونة من تتاليات مكررة مع وجود فواصل بين كل تكرار وآخر.
عندما نتحدث عن التكرارات في الشيفرة الجينية، فنحن نقصد ترتيب الدرجات -أزواج الأسس- في السلم الحلزوني لجزيئة الدنا.
في قطاع كريسبر من الحمض النووي، تظهر هذه الأسس بالترتيب ذاته عدة مرات، وبهذه الأجزاء المكررة، تتشكل متتاليات متناظرة تُسمى (palindromic).
معنى ذلك أن الأسس على أحد طاقي الدنا توافق تلك التي على الجانب الآخر -من الطاق ذاته- عند قراءته معكوسًا، مثل كلمة (racecar) التي تُقرأ بالاتجاهين.
تظهر التكرارات المتناظرة القصيرة في جميع مناطق كريسبر من الحمض النووي، وكل تكرار محاصر بفواصل. تسرق البكتيريا مثل هذه الفواصل من الفيروسات التي هاجمتها، ما يعني أنها تدمج جزءًا من الحمض النووي الفيروسي في جينومها. تعمل هذه الفواصل بنكًا للذكريات، يمكن البكتيريا من التعرف على الفيروسات حال هاجمتها مرة أخرى.
وصف فريق من الباحثين من شركة دانيسكو هذه العملية في ورقة بحثية نُشرت عام 2007، إذ استخدموا بكتيريا العقديات الحرارية (نموذجًا)، التي توجد عادةً في منتجات الألبان، ولاحظوا أنه بعد حدوث هجوم فيروسي، تدمج البكتيريا فواصل جديدة في مناطق كريسبر الخاصة بها. تسلسل النكليوتيدات لهذه الفواصل مطابق لأجزاء من جينوم الفيروس.
رنا كريسبر (crRNA):
تعمل مناطق كريسبر في الدنا مثل بنك للذكريات الفيروسية، لكن كي تكون هذه المعلومات المخزنة مفيدة في أي مكان آخر بالخلية، يجب نسخها إلى مكون وراثي آخر يُسمى الرنا. على عكس تتاليات الدنا، التي تظل ضمن جزيء الدنا، يمكن رنا كريسبر أن يتجول في الخلية ويتعاون مع البروتينات، فيتشكل المقص الجزيئي الذي يقص الفيروسات إلى أجزاء صغيرة.
يختلف الحمض النووي رنا عن الحمض النووي دنا في أنه طاق واحد فقط، بدلًا من اثنين، أي يبدو مثل نصف سلم فقط. لتشكيل جزيء الرنا، يعمل جزء من كريسبر -في الدنا- مرصافًا، وتكوّن بروتينات بوليميراز جزيء رنا متممًا لهذا الطاق، ما يعني أن قواعد الطاقين ستتقابل معًا مثل قطع التركيب. مثلًا، يُنسخ G في جزيء الدنا إلى C في الرنا.
تحتوي كل قصاصة من رنا كريسبر على نسخة من تكرار وفاصل من منطقة كريسبر من الدنا، يتفاعل الرنا كريسبر مع بروتين كاس9 ونوع آخر من الحمض النووي الريبي، يُسمى (tracrRNA)، لمساعدة البكتيريا ضد الفيروسات.
كاس 9
هو إنزيم يقطع الدنا الغريب. يرتبط البروتين بـرنا كريسبر وtracrRNA، اللذان يوجهانه إلى موقع مستهدف على طاق دنا الفيروس حيث سيقطع البروتين. الحمض النووي المستهدف الذي سيقطع عنده يكون متممًا لامتداد 20 نيوكليوتيدة من رنا كريسبر.
تجدر الإشارة إلى أن الإنزيم كاس9 يقطع كلا طاقي الدنا الحلزوني.
توجد آلية أمان تضمن عدم قطع كاس9 في أي مكان من الجينوم. تعمل سلاسل الحمض النووي القصيرة المعروفة باسم «العناصر المجاورة لبداية الفواصل» أو (PAMs) إشارات مجاورة لتسلسل الدنا المستهدف. إذا لم يرَ معقد الإنزيم كاس9 سلاسل PAMs بجوار تسلسل الدنا المستهدف، فلن يُقطع، هذا من الأسباب المحتملة لعدم مهاجمة كاس9 منطقة كريسبر الخاصة بالبكتيريا.
كيف يعمل كريسبر أداةً للتعديل الجيني؟

فيما يلي تفصيل لكيفية استخدام كريسبر للتعديل الجيني.
ترمز الجينومات لسلاسل من التعليمات ضمن تسلسل الدنا، وتعديل الجينوم يعني تغيير تلك التسلسلات، ومن ثم تغيير الرسائل المتضمنة به. يمكن ذلك بإحداث قطع في الدنا وخداع الآليات الطبيعية لإصلاح عيوب الدنا الموجودة في الخلية لإحداث التغييرات المطلوبة. كريسبر-كاس9 هو وسيلة لذلك.
تصف ورقة بحثية نُشرت عام 2012، استخدام كريسبر-كاس9 البكتيري لقطع أي دنا، وليس فقط الدنا الفيروسي. بهذا يمكن تحويل نظام كريسبر الطبيعي إلى أداة بسيطة يمكن برمجتها لتعديل الجينوم.
لتوجيه كاس9 لقص منطقة محددة من الدنا، يمكن العلماء ببساطة تغيير تسلسل رنا كريسبر الذي يرتبط بالتسلسل المتمم في الحمض النووي المستهدف. في دراسة عام 2012، بسّط الباحثون النظام بدمج رنا كريسبر و (tracrRNA) لإنشاء «رنا موجه». على هذا، يتطلب تحرير الجينوم مكونين فقط: رنا موجه وبروتين كاس9.
يقول جورج تشيرش، أستاذ علم الوراثة في كلية الطب بجامعة هارفارد: «عمليًا، نصمم امتدادًا يتكون من 20 زوجًا أساسيًا يتطابق مع الجين المراد تعديله».
بهذا تمكن معرفة تسلسل الرنا المتمم. أكد تشيرش أهمية التحقق من أن تسلسل النيوكليوتيدات المختار موجود فقط في الجين المستهدف وليس في أي مكان آخر في الجينوم.
«ثم يقطع الحمض النووي الريبي والبروتين كاس9 -مثل المقص- الدنا في هذا الموقع تحديدًا، وليس في أي موقع آخر». فور قطع الحمض النووي، تبدأ آليات الإصلاح الطبيعية للخلية بالتدخل، وتعمل على إعادة تجميع الحمض النووي، في هذه المرحلة، يمكن إجراء تعديلات على الجينوم. وذلك بإحدى طريقتين:
أولًا، لصق القطعتين معًا مرة أخرى. قد تؤدي هذه الطريقة، المعروفة باسم «ضم النهايات غير المتجانسة»، إلى أخطاء، بإدخال النيوكليوتيدات أو حذفها بطريق الخطأ، ما قد يؤدي إلى حدوث طفرات تعطل الجين.
ثانيًا، إصلاح القطع بملء الفراغ بسلسلة من النيوكليوتيدات. تستخدم الخلية طاقًا قصيرًا من الدنا قالبًا. يمكن العلماء اختيار قالب الحمض النووي لكتابة أي جين يريدونه، أو لتصحيح طفرة ما.
من اكتشف تقنية كريسبر؟
اكتُشف كريسبر على يد باحثين في جامعة أوساكا اليابان، في بكتيريا الإشريكية القولونية عام 1987، لم يفهم العلماء في البداية الأهمية البيولوجية لتسلسلات الدنا هذه، ولم يكن الاسم قد وُجد بعد. ومع تطور تقنيات التحليل الجيني في التسعينيات، وجد باحثون آخرون تتاليات كريسبر في العديد من الميكروبات الأخرى.
يُعد فرانسيسكو موخيكا، العالم في جامعة أليكانتي في إسبانيا، أول من وصف الخصائص المميزة لكريسبر، وهو أول من اختار الاسم، الذي ظهر للمرة الأولى في مقال عام 2002، نُشر في مجلة الميكروبيولوجيا الجزيئية، كتبه رود جينسن من جامعة أوتريخت.
ينسب الفضل إلى العالمتين جينيفر دودنا، أستاذة الكيمياء الحيوية والفيزياء الحيوية والبيولوجيا الهيكلية في جامعة كاليفورنيا بيركلي، وإيمانويل شاربنتييه، مديرة وحدة ماكس بلانك لعلوم العوامل الممرضة، في تشكيل نظام أداة لتعديل الجينات باستخدام نظام كريسبر/كاس البكتيري، وقد تشاركتا جائزة نوبل 2020 في الكيمياء.
أوضح عالم الكيمياء الحيوية فينغ زانغ من معهد برود أن نظام كريسبر يعمل في خلايا الثدييات، بناءً على هذا الاكتشاف، حصل معهد برود على أول براءة اختراع لاستخدام تقنية كريسبر لتعديل الجينات في حقيقيات النوى.
كيف يُستخدم كريسبر؟
أظهرت الدراسات التي أجريت في المختبر والنماذج الحيوانية للأمراض البشرية أن بوسع هذه التقنية تصحيح العيوب الجينية بفعالية. مثل أمراض التليف الكيسي، والساد، وفقر دم فانكوني. مهدت هذه الدراسات الطريق لتطبيقات علاجية على البشر.
في مجال الطب، اختبرت كريسبر في المراحل المبكرة من التجارب السريرية علاجًا للسرطان ولاضطراب وراثي يسبب العمى. واختبرت إستراتيجية لمنع انتشار داء لايم والملاريا من ناقلات فيروسية إلى البشر.
قال نيفيل سانجانا من مركز الجينوم في نيويورك والأستاذ المساعد في البيولوجيا وعلم الأعصاب والفيزيولوجيا في جامعة نيويورك: «أعتقد أن التصور العام لكريسبر يركز بشدة على فكرة استخدام تعديل الجينات سريريًا لعلاج الأمراض. هذا بالتأكيد استخدام عظيم للتقنية، لكنه أحد الاستخدامات الكثيرة الممكنة».
طُبقت تقنية كريسبر أيضًا في الصناعات الغذائية والزراعية لتشكيل مستنبتات جرثومية مفيدة، ولحماية هذه الجراثيم في المنتجات المُصنعة، مثل اللبن، ضد الفيروسات. واستخدم في المحاصيل لتحسين الإنتاج وتحمل الجفاف وتحسين خصائصها المغذية.
من التطبيقات الممكنة، إنشاء محركات جينية، وهي من تقنيات الهندسة الوراثية التي تزيد فرص انتقال سمة معينة من الوالدين إلى الأبناء، على مدار الأجيال، تنتشر السمة إلى مجموعات كبيرة من هذا النوع. يمكن استخدام محركات الجينات في تطبيقات مختلفة، مثل القضاء على الأنواع الغازية للمحاصيل أو عكس مقاومة مبيدات الآفات ومبيدات الأعشاب في المحاصيل.
خلال جائحة كوفيد-19، استُخدم نظام كريسبر-كاس9 لتطوير اختبارات تشخيصية مختلفة للعدوى الفيروسية.
استُخدمت تقنية كريسبر حديثًا بالطرق التالية:
في 2 أغسطس 2017، كشف العلماء في مجلة نيتشر أنهم نجحوا في إزالة عيب يسبب مرضًا قلبيًا لدى جنين باستخدام تقنية كريسبر.
في 16 أبريل 2018، طوّر الباحثون تقنية كريسبر لتعديل آلاف الجينات في الوقت ذاته، وفقًا لبحث نشرته مجلة بيونيوز.
رغم الاستخدامات الواسعة لتقنية كريسبر، فإنها لا تخلو من بعض العيوب.
قال تشيرش: «أعتقد أن أكثر ما يقيد تقنية كريسبر هو أنها ليست فعالة 100%». أي أن تقنية كريسبر تنجح فقط في تعديل نسبة من الحمض النووي المستهدف.
أيضًا قد تسبب التقنية آثارًا غير مقصودة، إذ يُقطع الحمض النووي في مواقع مختلفة عن الهدف المقصود. قد تحدث طفرات أو تعديل غير دقيق للهدف، ما يُسمى تخريب الجينوم.
المخاطر المحتملة والمخاوف الأخلاقية لاستخدام تقنية كريسبر
تثير التطبيقات العديدة المحتملة لتقنية كريسبر تساؤلات حول فوائدها من جهة والعواقب الأخلاقية للتلاعب بالجينومات من جهة أخرى. على وجه الخصوص، أُثيرت مجموعة كبيرة من المناقشات الأخلاقية عام 2018 عندما أعلن هي جيانكوي، عالِم الفيزياء الحيوية سابقًا في الجامعة الجنوبية للعلوم والتكنولوجيا في شينزين، أن فريقه عدّل الحمض النووي لأجنة بشرية، وهو أول تعديل جيني على الأطفال في العالم.
حُكم عليه بعد ذلك بالسجن ثلاث سنوات وغرامة قدرها 3 ملايين يوان (560 ألف دولار) لممارسته مهنة الطب دون ترخيص، وانتهاك القواعد الصينية بشأن تقنيات الإنجاب، وتلفيق وثائق المراجعة الأخلاقية. أثارت تجاربه أسئلة حول كيفية تنظيم استخدام كريسبر.
يُعرف إجراء تعديلات جينية على الأجنة البشرية والخلايا الإنجابية -مثل الحيوانات المنوية والبويضات- باسم تعديل الخط الجنسي. لأن التغييرات التي تطرأ على هذه الخلايا قد تنتقل إلى الأجيال اللاحقة، فإن استخدام تقنية كريسبر لإجراء تعديلات في هذا المجال يثير عدة مخاوف الأخلاقية.
في مقال عام 2014، أشار أوي وزملاؤه إلى التأثير البيئي المحتمل لاستخدام محركات الجينات، قد تنتشر السمة المقدمة إلى المجموعة المستهدفة إلى كائنات أخرى من خلال التهجين. يمكن المحركات الجينية أيضًا أن تقلل التنوع الجيني للمجموعة المستهدفة، ما قد يقلل قدرتها على البقاء.
من المخاوف الأخلاقية أيضًا، هل يُسمح بإجراء تغييرات قد تؤثر في الأجيال القادمة دون موافقتهم؟ ماذا لو تحول استخدام تعديل الخط الجنسي من أداة علاجية إلى أداة لتعزيز الخصائص البشرية؟
لمواجهة هذه المخاوف ، وضعت الأكاديميات الوطنية للعلوم والهندسة والطب تقريرًا شاملًا مع إرشادات وتوصيات بخصوص تعديل الجينوم.
مع أن الأكاديميات الوطنية تحث على توخي الحذر في متابعة تعديل الخط الجنسي، أكدت أن «الحذر لا يعني الحظر». ويوصون بتعديل الخط الجنسي فقط على الجينات التي تؤدي إلى أمراض خطيرة، حال عدم وجود بدائل علاجية أخرى معقولة. ويؤكدون الحاجة إلى جمع البيانات حول المخاطر والفوائد الصحية والحفاظ على الإشراف المستمر في أثناء التجارب السريرية. ويوصون منظمي التجربة بمتابعة عائلات المشاركين بعد انتهاء التجربة عدة أجيال لمعرفة التغيرات المستمرة في الجينوم بمرور الوقت.
كريسبر أداة للتعديل الجيني، تسمح للباحثين بأن يعدلوا تتاليات الحمض النووي الريبي منقوص الأوكسجين «دنا»، ومن ثم إحداث تغيير في وظيفة الجين.
للتقنية عدة تطبيقات، منها تصحيح الأخطاء الجينية، وعلاج الأمراض والوقاية من انتشارها، وتحسين نمو المحاصيل. ومع أنها تقنية واعدة، فإنها تثير العديد من المخاوف الأخلاقية.
مصطلح كريسبر (CRISPR) هو اختصار لـ (CRISPR-Cas9). كريسبر هو امتدادات من الدنا مع البروتين كاس9 (Cas9)، وهو إنزيم يعمل مقصًا جزيئيًا قادرًا على قطع سلاسل الدنا.
استمدت تقنية كريسبر من آليات الدفاع الطبيعية للبكتيريا والعتائق، وهي مجموعة من العضيات وحيدة الخلية تُسمى العضيات الميكروية. تستخدم هذه العضيات الحمض النووي الريبي «الرنا» المشتق من دنا كريسبر، والعديد من بروتينات كاس لتحبط هجوم الفيروسات. إذ تقطّع العضية الدنا الفيروسي وترتب أجزاء منه في جينومها لتستخدمه سلاحًا ضد الفيروسات الغازية حال هاجمت مجددًا.
عند نقل مكونات الكريسبر إلى عضية أخرى أعقد، ستتمكن هذه المكونات من التلاعب بالجينات، ما يُسمى التعديل الجيني.
المكونات الرئيسية لكريسبر
جزيئة دنا مضاعف الطاق، مكون من أزواج من الأسس: إما أدنين يقابله تايمين أو سيتوزين يقابله غوانين.

يعني مصطلح CRISPR: التكرارات العنقودية المتناظرة القصيرة منتظمة التباعد، ما يعني قطعة من الدنا مكونة من تتاليات مكررة مع وجود فواصل بين كل تكرار وآخر.
عندما نتحدث عن التكرارات في الشيفرة الجينية، فنحن نقصد ترتيب الدرجات -أزواج الأسس- في السلم الحلزوني لجزيئة الدنا.
في قطاع كريسبر من الحمض النووي، تظهر هذه الأسس بالترتيب ذاته عدة مرات، وبهذه الأجزاء المكررة، تتشكل متتاليات متناظرة تُسمى (palindromic).
معنى ذلك أن الأسس على أحد طاقي الدنا توافق تلك التي على الجانب الآخر -من الطاق ذاته- عند قراءته معكوسًا، مثل كلمة (racecar) التي تُقرأ بالاتجاهين.
تظهر التكرارات المتناظرة القصيرة في جميع مناطق كريسبر من الحمض النووي، وكل تكرار محاصر بفواصل. تسرق البكتيريا مثل هذه الفواصل من الفيروسات التي هاجمتها، ما يعني أنها تدمج جزءًا من الحمض النووي الفيروسي في جينومها. تعمل هذه الفواصل بنكًا للذكريات، يمكن البكتيريا من التعرف على الفيروسات حال هاجمتها مرة أخرى.
وصف فريق من الباحثين من شركة دانيسكو هذه العملية في ورقة بحثية نُشرت عام 2007، إذ استخدموا بكتيريا العقديات الحرارية (نموذجًا)، التي توجد عادةً في منتجات الألبان، ولاحظوا أنه بعد حدوث هجوم فيروسي، تدمج البكتيريا فواصل جديدة في مناطق كريسبر الخاصة بها. تسلسل النكليوتيدات لهذه الفواصل مطابق لأجزاء من جينوم الفيروس.
رنا كريسبر (crRNA):
تعمل مناطق كريسبر في الدنا مثل بنك للذكريات الفيروسية، لكن كي تكون هذه المعلومات المخزنة مفيدة في أي مكان آخر بالخلية، يجب نسخها إلى مكون وراثي آخر يُسمى الرنا. على عكس تتاليات الدنا، التي تظل ضمن جزيء الدنا، يمكن رنا كريسبر أن يتجول في الخلية ويتعاون مع البروتينات، فيتشكل المقص الجزيئي الذي يقص الفيروسات إلى أجزاء صغيرة.
يختلف الحمض النووي رنا عن الحمض النووي دنا في أنه طاق واحد فقط، بدلًا من اثنين، أي يبدو مثل نصف سلم فقط. لتشكيل جزيء الرنا، يعمل جزء من كريسبر -في الدنا- مرصافًا، وتكوّن بروتينات بوليميراز جزيء رنا متممًا لهذا الطاق، ما يعني أن قواعد الطاقين ستتقابل معًا مثل قطع التركيب. مثلًا، يُنسخ G في جزيء الدنا إلى C في الرنا.
تحتوي كل قصاصة من رنا كريسبر على نسخة من تكرار وفاصل من منطقة كريسبر من الدنا، يتفاعل الرنا كريسبر مع بروتين كاس9 ونوع آخر من الحمض النووي الريبي، يُسمى (tracrRNA)، لمساعدة البكتيريا ضد الفيروسات.
كاس 9
هو إنزيم يقطع الدنا الغريب. يرتبط البروتين بـرنا كريسبر وtracrRNA، اللذان يوجهانه إلى موقع مستهدف على طاق دنا الفيروس حيث سيقطع البروتين. الحمض النووي المستهدف الذي سيقطع عنده يكون متممًا لامتداد 20 نيوكليوتيدة من رنا كريسبر.
تجدر الإشارة إلى أن الإنزيم كاس9 يقطع كلا طاقي الدنا الحلزوني.
توجد آلية أمان تضمن عدم قطع كاس9 في أي مكان من الجينوم. تعمل سلاسل الحمض النووي القصيرة المعروفة باسم «العناصر المجاورة لبداية الفواصل» أو (PAMs) إشارات مجاورة لتسلسل الدنا المستهدف. إذا لم يرَ معقد الإنزيم كاس9 سلاسل PAMs بجوار تسلسل الدنا المستهدف، فلن يُقطع، هذا من الأسباب المحتملة لعدم مهاجمة كاس9 منطقة كريسبر الخاصة بالبكتيريا.
كيف يعمل كريسبر أداةً للتعديل الجيني؟

فيما يلي تفصيل لكيفية استخدام كريسبر للتعديل الجيني.
ترمز الجينومات لسلاسل من التعليمات ضمن تسلسل الدنا، وتعديل الجينوم يعني تغيير تلك التسلسلات، ومن ثم تغيير الرسائل المتضمنة به. يمكن ذلك بإحداث قطع في الدنا وخداع الآليات الطبيعية لإصلاح عيوب الدنا الموجودة في الخلية لإحداث التغييرات المطلوبة. كريسبر-كاس9 هو وسيلة لذلك.
تصف ورقة بحثية نُشرت عام 2012، استخدام كريسبر-كاس9 البكتيري لقطع أي دنا، وليس فقط الدنا الفيروسي. بهذا يمكن تحويل نظام كريسبر الطبيعي إلى أداة بسيطة يمكن برمجتها لتعديل الجينوم.
لتوجيه كاس9 لقص منطقة محددة من الدنا، يمكن العلماء ببساطة تغيير تسلسل رنا كريسبر الذي يرتبط بالتسلسل المتمم في الحمض النووي المستهدف. في دراسة عام 2012، بسّط الباحثون النظام بدمج رنا كريسبر و (tracrRNA) لإنشاء «رنا موجه». على هذا، يتطلب تحرير الجينوم مكونين فقط: رنا موجه وبروتين كاس9.
يقول جورج تشيرش، أستاذ علم الوراثة في كلية الطب بجامعة هارفارد: «عمليًا، نصمم امتدادًا يتكون من 20 زوجًا أساسيًا يتطابق مع الجين المراد تعديله».
بهذا تمكن معرفة تسلسل الرنا المتمم. أكد تشيرش أهمية التحقق من أن تسلسل النيوكليوتيدات المختار موجود فقط في الجين المستهدف وليس في أي مكان آخر في الجينوم.
«ثم يقطع الحمض النووي الريبي والبروتين كاس9 -مثل المقص- الدنا في هذا الموقع تحديدًا، وليس في أي موقع آخر». فور قطع الحمض النووي، تبدأ آليات الإصلاح الطبيعية للخلية بالتدخل، وتعمل على إعادة تجميع الحمض النووي، في هذه المرحلة، يمكن إجراء تعديلات على الجينوم. وذلك بإحدى طريقتين:
أولًا، لصق القطعتين معًا مرة أخرى. قد تؤدي هذه الطريقة، المعروفة باسم «ضم النهايات غير المتجانسة»، إلى أخطاء، بإدخال النيوكليوتيدات أو حذفها بطريق الخطأ، ما قد يؤدي إلى حدوث طفرات تعطل الجين.
ثانيًا، إصلاح القطع بملء الفراغ بسلسلة من النيوكليوتيدات. تستخدم الخلية طاقًا قصيرًا من الدنا قالبًا. يمكن العلماء اختيار قالب الحمض النووي لكتابة أي جين يريدونه، أو لتصحيح طفرة ما.
من اكتشف تقنية كريسبر؟
اكتُشف كريسبر على يد باحثين في جامعة أوساكا اليابان، في بكتيريا الإشريكية القولونية عام 1987، لم يفهم العلماء في البداية الأهمية البيولوجية لتسلسلات الدنا هذه، ولم يكن الاسم قد وُجد بعد. ومع تطور تقنيات التحليل الجيني في التسعينيات، وجد باحثون آخرون تتاليات كريسبر في العديد من الميكروبات الأخرى.
يُعد فرانسيسكو موخيكا، العالم في جامعة أليكانتي في إسبانيا، أول من وصف الخصائص المميزة لكريسبر، وهو أول من اختار الاسم، الذي ظهر للمرة الأولى في مقال عام 2002، نُشر في مجلة الميكروبيولوجيا الجزيئية، كتبه رود جينسن من جامعة أوتريخت.
ينسب الفضل إلى العالمتين جينيفر دودنا، أستاذة الكيمياء الحيوية والفيزياء الحيوية والبيولوجيا الهيكلية في جامعة كاليفورنيا بيركلي، وإيمانويل شاربنتييه، مديرة وحدة ماكس بلانك لعلوم العوامل الممرضة، في تشكيل نظام أداة لتعديل الجينات باستخدام نظام كريسبر/كاس البكتيري، وقد تشاركتا جائزة نوبل 2020 في الكيمياء.
أوضح عالم الكيمياء الحيوية فينغ زانغ من معهد برود أن نظام كريسبر يعمل في خلايا الثدييات، بناءً على هذا الاكتشاف، حصل معهد برود على أول براءة اختراع لاستخدام تقنية كريسبر لتعديل الجينات في حقيقيات النوى.
كيف يُستخدم كريسبر؟
أظهرت الدراسات التي أجريت في المختبر والنماذج الحيوانية للأمراض البشرية أن بوسع هذه التقنية تصحيح العيوب الجينية بفعالية. مثل أمراض التليف الكيسي، والساد، وفقر دم فانكوني. مهدت هذه الدراسات الطريق لتطبيقات علاجية على البشر.
في مجال الطب، اختبرت كريسبر في المراحل المبكرة من التجارب السريرية علاجًا للسرطان ولاضطراب وراثي يسبب العمى. واختبرت إستراتيجية لمنع انتشار داء لايم والملاريا من ناقلات فيروسية إلى البشر.
قال نيفيل سانجانا من مركز الجينوم في نيويورك والأستاذ المساعد في البيولوجيا وعلم الأعصاب والفيزيولوجيا في جامعة نيويورك: «أعتقد أن التصور العام لكريسبر يركز بشدة على فكرة استخدام تعديل الجينات سريريًا لعلاج الأمراض. هذا بالتأكيد استخدام عظيم للتقنية، لكنه أحد الاستخدامات الكثيرة الممكنة».
طُبقت تقنية كريسبر أيضًا في الصناعات الغذائية والزراعية لتشكيل مستنبتات جرثومية مفيدة، ولحماية هذه الجراثيم في المنتجات المُصنعة، مثل اللبن، ضد الفيروسات. واستخدم في المحاصيل لتحسين الإنتاج وتحمل الجفاف وتحسين خصائصها المغذية.
من التطبيقات الممكنة، إنشاء محركات جينية، وهي من تقنيات الهندسة الوراثية التي تزيد فرص انتقال سمة معينة من الوالدين إلى الأبناء، على مدار الأجيال، تنتشر السمة إلى مجموعات كبيرة من هذا النوع. يمكن استخدام محركات الجينات في تطبيقات مختلفة، مثل القضاء على الأنواع الغازية للمحاصيل أو عكس مقاومة مبيدات الآفات ومبيدات الأعشاب في المحاصيل.
خلال جائحة كوفيد-19، استُخدم نظام كريسبر-كاس9 لتطوير اختبارات تشخيصية مختلفة للعدوى الفيروسية.
استُخدمت تقنية كريسبر حديثًا بالطرق التالية:
في 2 أغسطس 2017، كشف العلماء في مجلة نيتشر أنهم نجحوا في إزالة عيب يسبب مرضًا قلبيًا لدى جنين باستخدام تقنية كريسبر.
في 16 أبريل 2018، طوّر الباحثون تقنية كريسبر لتعديل آلاف الجينات في الوقت ذاته، وفقًا لبحث نشرته مجلة بيونيوز.
رغم الاستخدامات الواسعة لتقنية كريسبر، فإنها لا تخلو من بعض العيوب.
قال تشيرش: «أعتقد أن أكثر ما يقيد تقنية كريسبر هو أنها ليست فعالة 100%». أي أن تقنية كريسبر تنجح فقط في تعديل نسبة من الحمض النووي المستهدف.
أيضًا قد تسبب التقنية آثارًا غير مقصودة، إذ يُقطع الحمض النووي في مواقع مختلفة عن الهدف المقصود. قد تحدث طفرات أو تعديل غير دقيق للهدف، ما يُسمى تخريب الجينوم.
المخاطر المحتملة والمخاوف الأخلاقية لاستخدام تقنية كريسبر
تثير التطبيقات العديدة المحتملة لتقنية كريسبر تساؤلات حول فوائدها من جهة والعواقب الأخلاقية للتلاعب بالجينومات من جهة أخرى. على وجه الخصوص، أُثيرت مجموعة كبيرة من المناقشات الأخلاقية عام 2018 عندما أعلن هي جيانكوي، عالِم الفيزياء الحيوية سابقًا في الجامعة الجنوبية للعلوم والتكنولوجيا في شينزين، أن فريقه عدّل الحمض النووي لأجنة بشرية، وهو أول تعديل جيني على الأطفال في العالم.
حُكم عليه بعد ذلك بالسجن ثلاث سنوات وغرامة قدرها 3 ملايين يوان (560 ألف دولار) لممارسته مهنة الطب دون ترخيص، وانتهاك القواعد الصينية بشأن تقنيات الإنجاب، وتلفيق وثائق المراجعة الأخلاقية. أثارت تجاربه أسئلة حول كيفية تنظيم استخدام كريسبر.
يُعرف إجراء تعديلات جينية على الأجنة البشرية والخلايا الإنجابية -مثل الحيوانات المنوية والبويضات- باسم تعديل الخط الجنسي. لأن التغييرات التي تطرأ على هذه الخلايا قد تنتقل إلى الأجيال اللاحقة، فإن استخدام تقنية كريسبر لإجراء تعديلات في هذا المجال يثير عدة مخاوف الأخلاقية.
في مقال عام 2014، أشار أوي وزملاؤه إلى التأثير البيئي المحتمل لاستخدام محركات الجينات، قد تنتشر السمة المقدمة إلى المجموعة المستهدفة إلى كائنات أخرى من خلال التهجين. يمكن المحركات الجينية أيضًا أن تقلل التنوع الجيني للمجموعة المستهدفة، ما قد يقلل قدرتها على البقاء.
من المخاوف الأخلاقية أيضًا، هل يُسمح بإجراء تغييرات قد تؤثر في الأجيال القادمة دون موافقتهم؟ ماذا لو تحول استخدام تعديل الخط الجنسي من أداة علاجية إلى أداة لتعزيز الخصائص البشرية؟
لمواجهة هذه المخاوف ، وضعت الأكاديميات الوطنية للعلوم والهندسة والطب تقريرًا شاملًا مع إرشادات وتوصيات بخصوص تعديل الجينوم.
مع أن الأكاديميات الوطنية تحث على توخي الحذر في متابعة تعديل الخط الجنسي، أكدت أن «الحذر لا يعني الحظر». ويوصون بتعديل الخط الجنسي فقط على الجينات التي تؤدي إلى أمراض خطيرة، حال عدم وجود بدائل علاجية أخرى معقولة. ويؤكدون الحاجة إلى جمع البيانات حول المخاطر والفوائد الصحية والحفاظ على الإشراف المستمر في أثناء التجارب السريرية. ويوصون منظمي التجربة بمتابعة عائلات المشاركين بعد انتهاء التجربة عدة أجيال لمعرفة التغيرات المستمرة في الجينوم بمرور الوقت.
