الفيروسات معروفة في الغالب بطبيعتها العدوانية والمعدية. صحيح أن معظم علاقات الفيروسات مع مُضيفيها علاقة ممرضة، ما يعني أنها تُسبب أمراضًا تتراوح من البرد الخفيف إلى الحالات الخطيرة مثل المتلازمة التنفسية الحادة سارس SARS، وهي تعمل عن طريق غزو الخلية المضيفة والسيطرة على الآليات الخلوية وإطلاق جزيئات فيروسية جديدة تستمر في إصابة المزيد من الخلايا وتسبب المرض. لكنها ليست كلها سيئة، يمكن لبعض الفيروسات أن تقتل الجراثيم المُضرة بينما يمكن للبعض الآخر محاربة الفيروسات الأكثر خطورة، مثل الجراثيم الواقية «البروبيوتيك probiotics» (نوع من الجراثيم تزيد من الاستجابة المناعية للإنسان)، ولدينا أيضًا العديد من الفيروسات الواقية في الجسم.
الجراثيم الواقية
آكلات الجراثيم Bacteriophages أو phages؛ عبارة عن فيروسات تصيب الجراثيم وتدمرها. توجد في الإنسان في بطانة الغشاء المخاطي في الجهاز الهضمي والجهاز التنفسي والأجهزة التناسلية.
المخاط أو الغشاء المخاطي عبارة عن مادة سميكة عديمة الشكل توفر حاجزًا مضادًا لغزو الجراثيم وتحمي الخلايا تحته من الإصابة.
تشير الأبحاث الحديثة إلى أن الجراثيم الموجودة في المخاط هي جزء من نظام المناعة الطبيعي لدينا؛ إذ تحمي جسم الإنسان من غزو الجراثيم الأكثر خطورة.
وقد استُخدمت الجراثيم بالفعل لعلاج الإسهال والتسمم الناجم عن جراثيم المكورات العنقودية Staphylococcus aureus والتهابات جراثيم السالمونيلا Salmonella والتهابات الجلد منذ ما يقارب القرن.
في قديم الأزل كانت المصادر الأولية للجراثيم هي الماء والأوساخ الموجودة على الجلد والهواء والصرف الصحي وحتى سوائل الجسم من المرضى المصابين. عُزلت الفيروسات من هذه المصادر ونُقّيت ثم استُخدمت للعلاج.
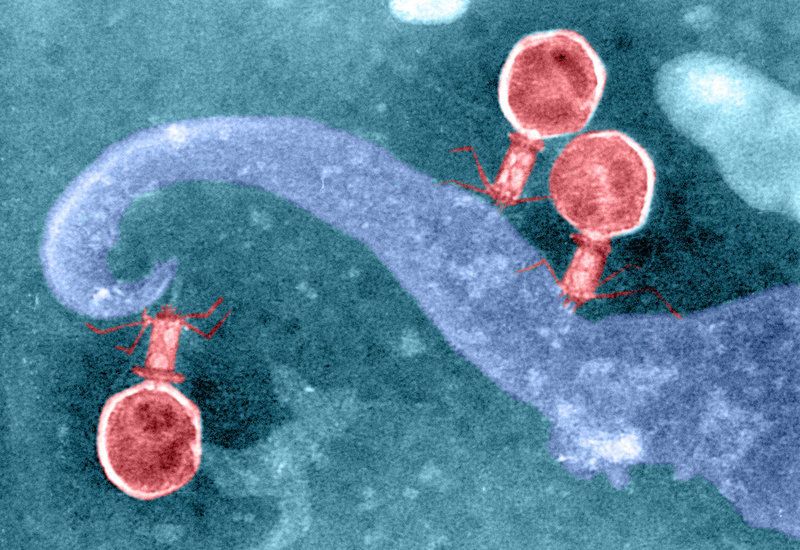
لقد جذبت آكلات الجراثيم Phages اهتمامًا متجددًا مع استمرار ظهور حالات العدوى المقاومة للعقاقير والمضادات الحيوية. ففي الآونة الأخيرة، ذُكر أن مراهقًا في المملكة المتحدة كان على وشك الموت من عدوى جراثيم لم تتمكن المضادات الحيوية من إبطالها، فاستُخدمت آكلات الجراثيم بنجاح لعلاج تلك العدوى الخطيرة.
الآن، الجراثيم تُعدَّل وراثيًا، وتُختبر سُلالات مختلفة من آكلات الجراثيم في مواجهة الجراثيم المستهدفة، وتُختار السلالات الأكثر فعاليةً وتُحفظ مجموعة من السلالات المقاومة؛ إذ يمكنها بعد ذلك مقاومة عدد كبير من الجراثيم الخطيرة، أو تُخصص وراثيًا لتقاوم نوعًا مُعينًا من الجراثيم.
قبل المرور بمرحلة العلاج، تُجمع مسحة من الجراثيم الموجودة في المنطقة المُصابة من المريض، ثم تُزرع في المختبر وتحدد السلالة الجرثومية، وتُختبر ضد مجموعة مختلفة من سلالات آكلات الجراثيم. بعد ذلك يختارون الآكلات المقاومة لتلك الجراثيم. ستُعطى مباشرةً عن طريق الفم أو موضعيًا على الجرح.
العدوى الفيروسية المفيدة
تُعد العدوى الفيروسية في سن مبكرة مهمة لضمان التطور السليم لأنظمتنا المناعية. بالإضافة إلى ذلك، يُحفز الجهاز المناعي بشكل مستمر عن طريق الفيروسات التي تُعتبر نسبة خطورتها منخفضة لتطوير مقاومة للعدوى الأخرى. بعض الفيروسات التي تصادفها تحمي البشر من الإصابة بالفيروسات الممرضة الأخرى.
على سبيل المثال، يمكن لفيروسات الهربس الكامنة Herpes Viruses أن تساعد الخلايا القاتلة الطبيعية -نوع محدد من خلايا الدم البيضاء- على تحديد الخلايا السرطانية والخلايا المصابة بفيروسات مسببة للأمراض الأخرى. تُسلح الفيروسات الخلايا القاتلة الطبيعية بالمستضدات Antigens (مادة غريبة يمكن أن تسبب استجابة مناعية في الجسم) والتي تمكنها من التعرف على الخلايا السرطانية.
هذا هو تكتيك البقاء على قيد الحياة من قِبل الفيروسات؛ وهو أن تستمر لفترة أطول داخل مضيفها «مصدر الطاقة»، والتخلص من الفيروسات الاخرى لمنعها من قتل المضيف.
في المُستقبل، يمكن استخدام أنواع معدلة من الفيروسات مثل هذه لاستهداف الخلايا السرطانية.
Pegivirus C و GBV-C هي فيروسات لا تُسبب أعراضًا مرضية، أظهرت دراسات متعددة أن مرضى فيروس نقص المناعة البشري HIV المصابون أيضًا بـ GBV-C يعيشون حياة أطول مقارنةً بالمرضى الذين لا يملكون هذا الفيروس.
يؤدي الفيروس إلى إبطاء تقدم المرض عن طريق منع مستقبلات المضيف المطلوبة لدخول الفيروس إلى الخلية، ويشجع إطلاق الإنترفيرون وسيتوكينات الكشف عن الفيروسات (البروتينات التي تنتجها خلايا الدم البيضاء التي تنشط الالتهاب وإزالة الخلايا المصابة أو مسببات الأمراض).
في مثال آخر، تبين أن NoroViruses تحمي أمعاء الفئران، عندما استَخدم العلماء مضادات حيوية لـ NoroViruses أصبحت أمعاء الفئران أكثر عرضة للإصابة بأي عدوى، وهذا يدل على أن noroviruses قادرة على حماية مضيفها.

مستقبل الفيروسات العلاجية
مكنتنا التكنولوجيا الحديثة من فهم المزيد عن تعقيدات المجتمعات الميكروبية التي تشكل جزءًا من جسم الإنسان. بالإضافة إلى الجراثيم الجيدة نعلم الآن بوجود فيروسات مفيدة في الأمعاء والجلد وحتى الدم.
إن فهمنا لهذا المكون الفيروسي ما يزال في بدايته، لكن لدينا إمكانيات هائلة ستساعدنا على فهم الالتهابات الفيروسية، والأهم من ذلك، كيف نحارب الأمراض السيئة.
يمكن أن يلقي هذا الفهم الضوء أيضًا على تطور الجينوم البشري والأمراض الوراثية وتطوير علاجات الجينات
الجراثيم الواقية
آكلات الجراثيم Bacteriophages أو phages؛ عبارة عن فيروسات تصيب الجراثيم وتدمرها. توجد في الإنسان في بطانة الغشاء المخاطي في الجهاز الهضمي والجهاز التنفسي والأجهزة التناسلية.
المخاط أو الغشاء المخاطي عبارة عن مادة سميكة عديمة الشكل توفر حاجزًا مضادًا لغزو الجراثيم وتحمي الخلايا تحته من الإصابة.
تشير الأبحاث الحديثة إلى أن الجراثيم الموجودة في المخاط هي جزء من نظام المناعة الطبيعي لدينا؛ إذ تحمي جسم الإنسان من غزو الجراثيم الأكثر خطورة.
وقد استُخدمت الجراثيم بالفعل لعلاج الإسهال والتسمم الناجم عن جراثيم المكورات العنقودية Staphylococcus aureus والتهابات جراثيم السالمونيلا Salmonella والتهابات الجلد منذ ما يقارب القرن.
في قديم الأزل كانت المصادر الأولية للجراثيم هي الماء والأوساخ الموجودة على الجلد والهواء والصرف الصحي وحتى سوائل الجسم من المرضى المصابين. عُزلت الفيروسات من هذه المصادر ونُقّيت ثم استُخدمت للعلاج.

لقد جذبت آكلات الجراثيم Phages اهتمامًا متجددًا مع استمرار ظهور حالات العدوى المقاومة للعقاقير والمضادات الحيوية. ففي الآونة الأخيرة، ذُكر أن مراهقًا في المملكة المتحدة كان على وشك الموت من عدوى جراثيم لم تتمكن المضادات الحيوية من إبطالها، فاستُخدمت آكلات الجراثيم بنجاح لعلاج تلك العدوى الخطيرة.
الآن، الجراثيم تُعدَّل وراثيًا، وتُختبر سُلالات مختلفة من آكلات الجراثيم في مواجهة الجراثيم المستهدفة، وتُختار السلالات الأكثر فعاليةً وتُحفظ مجموعة من السلالات المقاومة؛ إذ يمكنها بعد ذلك مقاومة عدد كبير من الجراثيم الخطيرة، أو تُخصص وراثيًا لتقاوم نوعًا مُعينًا من الجراثيم.
قبل المرور بمرحلة العلاج، تُجمع مسحة من الجراثيم الموجودة في المنطقة المُصابة من المريض، ثم تُزرع في المختبر وتحدد السلالة الجرثومية، وتُختبر ضد مجموعة مختلفة من سلالات آكلات الجراثيم. بعد ذلك يختارون الآكلات المقاومة لتلك الجراثيم. ستُعطى مباشرةً عن طريق الفم أو موضعيًا على الجرح.
العدوى الفيروسية المفيدة
تُعد العدوى الفيروسية في سن مبكرة مهمة لضمان التطور السليم لأنظمتنا المناعية. بالإضافة إلى ذلك، يُحفز الجهاز المناعي بشكل مستمر عن طريق الفيروسات التي تُعتبر نسبة خطورتها منخفضة لتطوير مقاومة للعدوى الأخرى. بعض الفيروسات التي تصادفها تحمي البشر من الإصابة بالفيروسات الممرضة الأخرى.
على سبيل المثال، يمكن لفيروسات الهربس الكامنة Herpes Viruses أن تساعد الخلايا القاتلة الطبيعية -نوع محدد من خلايا الدم البيضاء- على تحديد الخلايا السرطانية والخلايا المصابة بفيروسات مسببة للأمراض الأخرى. تُسلح الفيروسات الخلايا القاتلة الطبيعية بالمستضدات Antigens (مادة غريبة يمكن أن تسبب استجابة مناعية في الجسم) والتي تمكنها من التعرف على الخلايا السرطانية.
هذا هو تكتيك البقاء على قيد الحياة من قِبل الفيروسات؛ وهو أن تستمر لفترة أطول داخل مضيفها «مصدر الطاقة»، والتخلص من الفيروسات الاخرى لمنعها من قتل المضيف.
في المُستقبل، يمكن استخدام أنواع معدلة من الفيروسات مثل هذه لاستهداف الخلايا السرطانية.
Pegivirus C و GBV-C هي فيروسات لا تُسبب أعراضًا مرضية، أظهرت دراسات متعددة أن مرضى فيروس نقص المناعة البشري HIV المصابون أيضًا بـ GBV-C يعيشون حياة أطول مقارنةً بالمرضى الذين لا يملكون هذا الفيروس.
يؤدي الفيروس إلى إبطاء تقدم المرض عن طريق منع مستقبلات المضيف المطلوبة لدخول الفيروس إلى الخلية، ويشجع إطلاق الإنترفيرون وسيتوكينات الكشف عن الفيروسات (البروتينات التي تنتجها خلايا الدم البيضاء التي تنشط الالتهاب وإزالة الخلايا المصابة أو مسببات الأمراض).
في مثال آخر، تبين أن NoroViruses تحمي أمعاء الفئران، عندما استَخدم العلماء مضادات حيوية لـ NoroViruses أصبحت أمعاء الفئران أكثر عرضة للإصابة بأي عدوى، وهذا يدل على أن noroviruses قادرة على حماية مضيفها.

مستقبل الفيروسات العلاجية
مكنتنا التكنولوجيا الحديثة من فهم المزيد عن تعقيدات المجتمعات الميكروبية التي تشكل جزءًا من جسم الإنسان. بالإضافة إلى الجراثيم الجيدة نعلم الآن بوجود فيروسات مفيدة في الأمعاء والجلد وحتى الدم.
إن فهمنا لهذا المكون الفيروسي ما يزال في بدايته، لكن لدينا إمكانيات هائلة ستساعدنا على فهم الالتهابات الفيروسية، والأهم من ذلك، كيف نحارب الأمراض السيئة.
يمكن أن يلقي هذا الفهم الضوء أيضًا على تطور الجينوم البشري والأمراض الوراثية وتطوير علاجات الجينات
