غليان
Boiling - Ebullition
الغليان
الغليان boiling هو تبخر[ر] داخلي صاخب لسائل، وهو يحدث عندما ترتفع درجة حرارة السائل مقداراً كافياً تحت ضغط معيّن، فتتكون فقاقيع غازية صغيرة داخل السائل حيث يلامس السائل قعر الإناء الحمي، وهي تتألف من خليط من بخار السائل المُشْبَع ومن الهواء الذي كان محلولاً في السائل، أو كان على شكل طبقة رقيقة جداً بين السائل وقعر الإناء، وعندما يزداد ارتفاع درجة الحرارة يزداد حجم الفقاقيع وتصعد، حتى إذا وصلت إلى سطح السائل انفجرت وخرج ما فيها من بخار، ويشاهد السائل حينئذ في حالة جيشان ناشئٍ عن صعود الفقاقيع فيه.
ويخضع غليان سائل نقي إلى قانونين أساسيين:
1 - يغلي السائل الواقع تحت ضغط معين عند درجة حرارة ثابتة لا تتوقف إلا على طبيعة السائل النقي وعلى الضغط المؤثر فيه، وتسمى هذه الدرجة نقطة غليان السائل تحت هذا الضغط.
2 - درجة حرارة غليان سائل نقي هي الدرجة التي يكون عندها ضغط بخاره الإشباعي مساوياً ضغط الجو الغازي المؤثر فيه. ويبين الجدول درجات غليان بعض السوائل تحت الضغط الجوي العياري وهو 760مم زئبق.
وينجم عن هذا القانون الأخير نتائج مهمة عديدة:
أ - ازدياد درجة حرارة غليان سائل بازدياد الضغط المطبَّق عليه، فمثلاً تتغير درجة غليان الماء بالقرب من 100 ْس بمقدار درجة واحدة إذا اختلف الضغط عن 760مم زئبق بمقدار 27.2مم زئبق، فمثلاً تساوي هذه الدرجة 96 ْس حيث يبلغ الضغط نحو 650مم زئبق. كثيراً ما يعيَّن الضغط الجوي في مكانٍ ما بتعيين نقطة غليان الماء فيه. كذلك يُستفاد من تعيين نقطة غليان الماء في موقعٍ ما لمعرفة ارتفاع هذا الموقع عن سطح البحر، إذ كلما ازداد الارتفاع عن سطح البحر بمقدار 10 أمتار هبط الضغط الجوي بمقدار 1مم زئبق، أي ما يقابل نقصان نقطة غليان بمقدار 1/27 ْ س، ويسمى الجهاز المستعمل لهذا الغرض مقياس الارتفاع أو الهبسومتر hypsometer.
ب - إذا سخِّن السائل في إناء مغلق فيه جو غازي كالهواء، وكانت درجة حرارة أقسام الإناء جميعها متجانسة؛ فإن السائل لا يغلي مهما رُفعت درجة حرارته، ذلك لأن الضغط المطبق على السائل يساوي في أي درجة حرارة الضغطَ الإشباعي لبخار السائل مضافاً إليه ضغط الغاز، أي أنه يكون دائماً أكبر من ضغط بخار السائل الإشباعي؛ وعلى هذا يمكن الحصول على درجات حرارة أعلى من 100 ْس في الموصدات أو المحمَّات autclave، ويستفاد من هذا الأمر عملياً في صنع قِدْرٍ للطبخ في درجات حرارة أعلى من 100 ْس، وهو يتألف من وعاء متين الجدران يتحمل ضغطاً كبيراً ويثبَّت عليه بإحكام غطاء مزوَّد بصمام ينفتح تلقائياً عندما يبلغ الضغط قيمة معينة تراوح بين 1.5 ضغط جوي وضغطين جويين، وعندما ينفتح الصمام يبدأ الماء بالغليان في درجة حرارة تصل 120 ْس، وذلك عندما يبلغ الضغطُ ضغطين جويين. وتجهَّز القِدر بدسام أمان يمنع انفجار القدر إذا ارتفع الضغط ارتفاعاً مفاجئاً.
جـ - لا يمكن لسائل أن يغلي إلا إذا تمكّن بخاره من الإفلات، أو إذا استُعمل جهاز لتكثيف هذا البخار بتبريده، وهذه هي حالة التقطير distillation، التي تعتمد على مبدأ الجانب الأبرد أو مبدأ واط، وهو ينص على أنه إذا اختلفت درجة الحرارة في مناطق مختلفة من حيِّز محدود أو مغلق يحوي بخاراً مشبعاً، أي ملامساً سائله؛ فإن هذا السائل لا يستقر في هذا الحيز المحدود إلى أبرد منطقة في الحيز، ويصبح ضغط بخاره حينئذ مساوياً للضغط الإشباعي الموافق لدرجة حرارة هذه المنطقة، ويمكن تحقيق التقطير تحت الضغط الجوي في الهواء الطلق أو تحت ضغط أقل (الشكل -1)، وميزته خفض نقطة غليان السائل، فالغليسِّرول مثلاً يغلي عند الدرجة 290 ْس تقريباً تحت الضغط الجوي لكنه يتفكك، في حين أنه يغلي في الدرجة 160 ْس تقريباً تحت ضغط مقداره 10مم زئبق من دون أن يتفكك، كذلك يُحترز من رفع حرارة النتروغليسيرول عند تقطيره لأنه سريع الانفجار.
د - إذا وجد في وعاء مغلي سائل يعلوه بخاره وحسب، أي كان في حالة توازن مع بخاره، فإنه يمكن جعله يغلي في مختلف درجات الحرارة من دون تزويده بالحرارة، ويكفي لذلك أن يبرَّد جانب من الوعاء يلامس البخار فيتكاثف هذا البخار ويختل التوازن ويبدأ السائـل بالغليـان. ويبين الشكل (2) غلاّية فـرانْكلِن Franklin؛ وهي تتألف من حوجلة زجاجية طويلة الرقبة أُحكم إغلاقها بعد أن أُخرج هواؤها كلُّه، فإذا صُبَّ ماء بارد على جانبها وهي مقلوبة، غلا ماؤها بشدة وإن كان فاتراً.
أثبتت التجارب أنه إذا كان السائل المراد غلْيُهُ نقياً من الشوائب، ولاسيما من غازات ذائبة فيه؛ فإنه يمكن رفع درجة حرارة غليانه درجات عدة من دون أن يغلي، أي يتأخر الغليان. ولكن ما إن ترتفع درجة حرارة السائل فوق نقطة غليانه بمقدار كافٍ حتى يأخذ فجأة بالغليان بشدة، وبما يشبه الانفجار. وتُمنع ظاهرة تأخر الغليان بإلقاء قطع من الخزف أو من مادة مسامية أخرى تحمل هواء بين مسامها.
الحماوة الكروية calefaction
هناك ظاهرة تبدو لأول وهلة كأنها ظاهرة تأخر عن الغليان، وهي تحدث إذا صُبَّ سائلٌ باردٌ على سطح معدني حار جداً درجة حرارته أعلى كثيراً من نقطة غليان السائل، فيُرى أنه تتكون قطرات كروية تتحرك على السطح المعدني حركة راقصة مضطربة من دون أن تغلي، وسبب ذلك تكوُّنُ طبقة رقيقة من بخار السائل تحمل القطرة وتحول دون ملامستها السطح الحار. وتتوقف هذه الظاهرة عندما يبرد السطح المعدني، فتبدأ القطرات بالغليان الشديد المصحوب بتناثر أجزائها. وقد يكون سبب انفجار بعض المراجل البخارية ناشئاً عن انطلاق الأبخرة بشدة كبيرة عندما تتوقف ظاهرة الحماوة.
طاهر تربدار
Boiling - Ebullition
الغليان
الغليان boiling هو تبخر[ر] داخلي صاخب لسائل، وهو يحدث عندما ترتفع درجة حرارة السائل مقداراً كافياً تحت ضغط معيّن، فتتكون فقاقيع غازية صغيرة داخل السائل حيث يلامس السائل قعر الإناء الحمي، وهي تتألف من خليط من بخار السائل المُشْبَع ومن الهواء الذي كان محلولاً في السائل، أو كان على شكل طبقة رقيقة جداً بين السائل وقعر الإناء، وعندما يزداد ارتفاع درجة الحرارة يزداد حجم الفقاقيع وتصعد، حتى إذا وصلت إلى سطح السائل انفجرت وخرج ما فيها من بخار، ويشاهد السائل حينئذ في حالة جيشان ناشئٍ عن صعود الفقاقيع فيه.
| الماء | 100.00 ْس |
| الآزوت | 15908 ْس |
| الإتير العادي | 3406 ْس |
| الأكسجين | -183.0 ْس |
| الكحول الإتيلي | 7803 ْس |
| الهدروجين | - 252.8 ْس |
| الزئبق | 357 ْس |
1 - يغلي السائل الواقع تحت ضغط معين عند درجة حرارة ثابتة لا تتوقف إلا على طبيعة السائل النقي وعلى الضغط المؤثر فيه، وتسمى هذه الدرجة نقطة غليان السائل تحت هذا الضغط.
2 - درجة حرارة غليان سائل نقي هي الدرجة التي يكون عندها ضغط بخاره الإشباعي مساوياً ضغط الجو الغازي المؤثر فيه. ويبين الجدول درجات غليان بعض السوائل تحت الضغط الجوي العياري وهو 760مم زئبق.
وينجم عن هذا القانون الأخير نتائج مهمة عديدة:
أ - ازدياد درجة حرارة غليان سائل بازدياد الضغط المطبَّق عليه، فمثلاً تتغير درجة غليان الماء بالقرب من 100 ْس بمقدار درجة واحدة إذا اختلف الضغط عن 760مم زئبق بمقدار 27.2مم زئبق، فمثلاً تساوي هذه الدرجة 96 ْس حيث يبلغ الضغط نحو 650مم زئبق. كثيراً ما يعيَّن الضغط الجوي في مكانٍ ما بتعيين نقطة غليان الماء فيه. كذلك يُستفاد من تعيين نقطة غليان الماء في موقعٍ ما لمعرفة ارتفاع هذا الموقع عن سطح البحر، إذ كلما ازداد الارتفاع عن سطح البحر بمقدار 10 أمتار هبط الضغط الجوي بمقدار 1مم زئبق، أي ما يقابل نقصان نقطة غليان بمقدار 1/27 ْ س، ويسمى الجهاز المستعمل لهذا الغرض مقياس الارتفاع أو الهبسومتر hypsometer.
ب - إذا سخِّن السائل في إناء مغلق فيه جو غازي كالهواء، وكانت درجة حرارة أقسام الإناء جميعها متجانسة؛ فإن السائل لا يغلي مهما رُفعت درجة حرارته، ذلك لأن الضغط المطبق على السائل يساوي في أي درجة حرارة الضغطَ الإشباعي لبخار السائل مضافاً إليه ضغط الغاز، أي أنه يكون دائماً أكبر من ضغط بخار السائل الإشباعي؛ وعلى هذا يمكن الحصول على درجات حرارة أعلى من 100 ْس في الموصدات أو المحمَّات autclave، ويستفاد من هذا الأمر عملياً في صنع قِدْرٍ للطبخ في درجات حرارة أعلى من 100 ْس، وهو يتألف من وعاء متين الجدران يتحمل ضغطاً كبيراً ويثبَّت عليه بإحكام غطاء مزوَّد بصمام ينفتح تلقائياً عندما يبلغ الضغط قيمة معينة تراوح بين 1.5 ضغط جوي وضغطين جويين، وعندما ينفتح الصمام يبدأ الماء بالغليان في درجة حرارة تصل 120 ْس، وذلك عندما يبلغ الضغطُ ضغطين جويين. وتجهَّز القِدر بدسام أمان يمنع انفجار القدر إذا ارتفع الضغط ارتفاعاً مفاجئاً.
جـ - لا يمكن لسائل أن يغلي إلا إذا تمكّن بخاره من الإفلات، أو إذا استُعمل جهاز لتكثيف هذا البخار بتبريده، وهذه هي حالة التقطير distillation، التي تعتمد على مبدأ الجانب الأبرد أو مبدأ واط، وهو ينص على أنه إذا اختلفت درجة الحرارة في مناطق مختلفة من حيِّز محدود أو مغلق يحوي بخاراً مشبعاً، أي ملامساً سائله؛ فإن هذا السائل لا يستقر في هذا الحيز المحدود إلى أبرد منطقة في الحيز، ويصبح ضغط بخاره حينئذ مساوياً للضغط الإشباعي الموافق لدرجة حرارة هذه المنطقة، ويمكن تحقيق التقطير تحت الضغط الجوي في الهواء الطلق أو تحت ضغط أقل (الشكل -1)، وميزته خفض نقطة غليان السائل، فالغليسِّرول مثلاً يغلي عند الدرجة 290 ْس تقريباً تحت الضغط الجوي لكنه يتفكك، في حين أنه يغلي في الدرجة 160 ْس تقريباً تحت ضغط مقداره 10مم زئبق من دون أن يتفكك، كذلك يُحترز من رفع حرارة النتروغليسيرول عند تقطيره لأنه سريع الانفجار.
د - إذا وجد في وعاء مغلي سائل يعلوه بخاره وحسب، أي كان في حالة توازن مع بخاره، فإنه يمكن جعله يغلي في مختلف درجات الحرارة من دون تزويده بالحرارة، ويكفي لذلك أن يبرَّد جانب من الوعاء يلامس البخار فيتكاثف هذا البخار ويختل التوازن ويبدأ السائـل بالغليـان. ويبين الشكل (2) غلاّية فـرانْكلِن Franklin؛ وهي تتألف من حوجلة زجاجية طويلة الرقبة أُحكم إغلاقها بعد أن أُخرج هواؤها كلُّه، فإذا صُبَّ ماء بارد على جانبها وهي مقلوبة، غلا ماؤها بشدة وإن كان فاتراً.
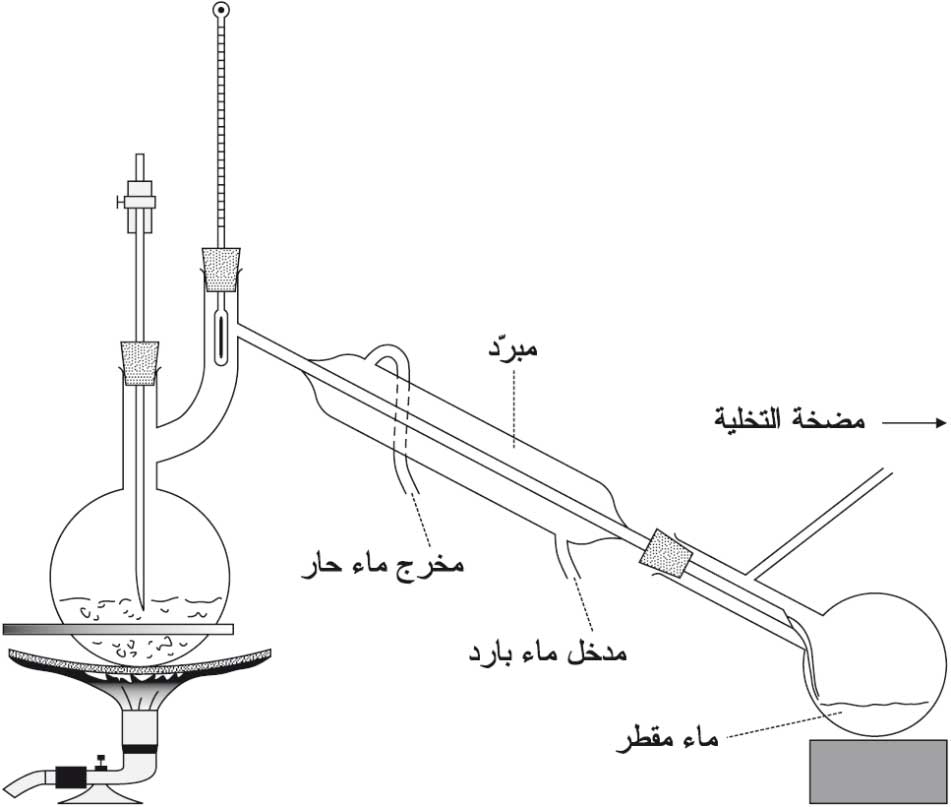 |
 |
| الشكل (1) | الشكل (2) تأخر الغليان |
الحماوة الكروية calefaction
هناك ظاهرة تبدو لأول وهلة كأنها ظاهرة تأخر عن الغليان، وهي تحدث إذا صُبَّ سائلٌ باردٌ على سطح معدني حار جداً درجة حرارته أعلى كثيراً من نقطة غليان السائل، فيُرى أنه تتكون قطرات كروية تتحرك على السطح المعدني حركة راقصة مضطربة من دون أن تغلي، وسبب ذلك تكوُّنُ طبقة رقيقة من بخار السائل تحمل القطرة وتحول دون ملامستها السطح الحار. وتتوقف هذه الظاهرة عندما يبرد السطح المعدني، فتبدأ القطرات بالغليان الشديد المصحوب بتناثر أجزائها. وقد يكون سبب انفجار بعض المراجل البخارية ناشئاً عن انطلاق الأبخرة بشدة كبيرة عندما تتوقف ظاهرة الحماوة.
طاهر تربدار
