حراره وقياسات حراريه
Heat and Thermal measurements - Chaleur et Mesures thermiques
الحرارة والقياسات الحرارية
ترتبط كمية الحرارة بدرجة الحرارة[ر] ارتباطاً وثيقاً، حتى إن بعضهم يستعمل كلمة «حرارة» لتدل على كليهما دلالة تفتقر إلى الدقة. فدرجة الحرارة temperature خاصة تساعد على تحديد حالة الجسم الحرارية، وهي مستمدة أولاً من الإحساس اللمسي، بينما كمية الحرارة أو الحرارة heat اختصاراً هي شكل من أشكال الطاقة وتقاس خلال انتقالها من جسم إلى آخر إذا كانت درجتا حرارتيهما مختلفتين.
وبصورة عامة، إذا أعطي جسم كمية من الحرارة ترتفع درجة حرارته، لكنه إذا وجدت المادة في طورين في حالة توازن عند درجة حرارة معينة قد لا يظهر تأثير كمية الحرارة على شكل تغير في درجة الحرارة وإنما سيظهر على شكل تغير في النسبة بين الطورين؛ مثل ما يحدث عندما يكون لدينا مزيج من الماء والجليد في الدرجة صفر مئوية تحت الضغط الجوي النظامي. إن تحديد حالة الجسم أو ما يعرف بصورة عامة بالجملة، يحتاج إضافة إلى تحديد درجة الحرارة تحديد قيم خواص أخرى، مثل الحجم أو الضغط أو النسبة في حالة المزيج، وهذا ما يتناوله علم التحريك الحراري[ر]. كان الكيميائي جوزيف بلاك Joseph Black عام 1770 أول من أشار بوضوح إلى ضرورة التمييز بين درجة الحرارة والحرارة. إذ كان لغزاً معرفة ما يحدث لدى وضع جسم حار على اتصال مع جسم أشد برودة منه، وخاصة السؤال عما ينتقل خلال هذه العملية. فوضعت نظرية الكالوري calory التي لم يبق منها إلا اسمها الذي أطلق على واحدة كمية الحرارة المعروفة بالاسم نفسه أو بالحريرة. لقد كان يعتقد، وفق هذه النظرية، بوجود سائل لا يرى يملأ كل شيء له وزن، مكون من جسيمات تتنافر فيما بينها وتتجاذب مع جسيمات المادة، وهو محفوظ. غير أن التجارب المختلفة والقياسات الدقيقة التي قام بها الكونت رمفورد ب. تومبسون B.Thompson، وجيمس جول[ر] J.Joule وسادي كارنو S.Carnot ربطت بين الحرارة المتولدة والعمل الميكانيكي المبذول، وكذلك مع الطاقة الكهربائية والطاقة الكيميائية، فتوصلوا إلى أن الحرارة ليست إلا شكلاً من أشكال الطاقة فأصبحت تقدر بالجول، كما عيّن المعادل الميكانيكي للحريرة. يعرف هذا التكافؤ الآن بالمبدأ الأول في الترموديناميك .
تتميز الطاقة الحرارية من الأشكال الأخرى، حين ينظر إلى حركة حاملاتها، بالعشوائية، لذلك فإن تحول الأشكال الأخرى إلى حرارة هو عملية سهلة تجري بصورة طبيعية ،مثل ظهورها عند الاحتكاك الميكانيكي أو عند مرور تيار كهربائي. غير أن تحويل الحرارة إلى الأشكال الأخرى عملية تحتاج إلى ترتيبات خاصة، وكان البحث عن أفضل المحركات الحرارية سبب ظهور علم التحريك الحراري. وقد أشار اللورد كلفن وهو و. تومبسون W.Thompson عام 1849 إلى تناقض نظرية الكالوري مع النتائج التجريبية، ثم أتى كلاوزيوس عام 1950 ليحل ما تبقى من تناقضات بإدخال مفهوم الأنتروبية[ر]، الذي يربط بين كمية الحرارة التي تتبادلها الجملة مع درجة الحرارة التي تم عندها التبادل على شكل نسبة بينهما، وقال إن هذه خاصة من خواص الجملة كطاقتها الداخلية.
القياسات الحرارية
يطلق اسم القياسات الحرارية على جميع القياسات التي تدخل فيها درجة الحرارة كمتحول، فهي تشمل مثلاً قياس الناقلية الحرارية والحرارة الكتلية[ر] والقوة المحركة الكهربائية في المزدوجة الكهرحرارية والإشعاع الحراري؛ إضافة إلى قياس حرارة الانصهار[ر] وحرارة التبخر وكميات الحرارة المرافقة لتغيرات الأطوار الأخرى مثل قياس كمية الحرارة المرافقة لتغير طور بعض المواد الصلبة المغنطيسية إلى طور لامغنطيسي، أو قياس كميات الحرارة الناتجة من التفاعلات الكيميائية.
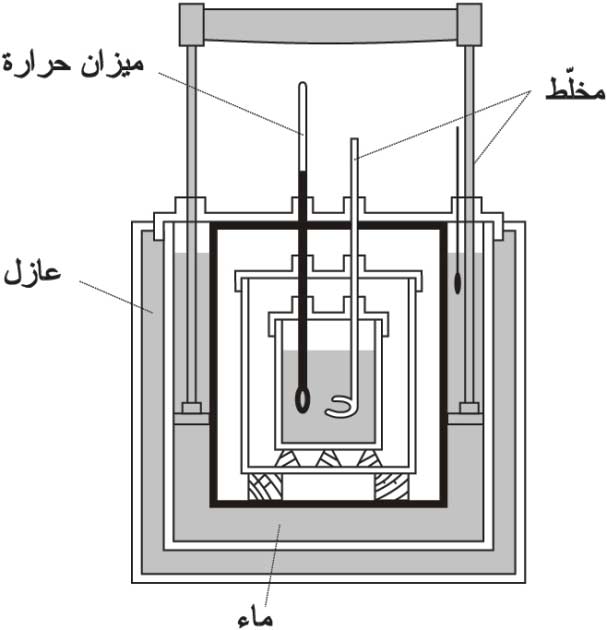
يجري التركيز في هذه القياسات على قياس كميات الحرارة المتبادلة بين كمية المادة أو الجملة المدروسة والوسط الخارجي. وقد لا تقتصر الكميات المتبادلة على ما يعطى للجملة أو ما تصدره فعلاً، إذ يوجد تبادل حراري دائم بالإشعاع أو بالتوصيل أو بالحمل، وهي تمثل طرائق انتقال الحرارة[ر] الرئيسة، لذلك تستعمل أجهزة مناسبة لكل نوع من القياسات تمكّن من الإقلال من الضياع أو حسابه. ويأتي ما يعرف باسم مقياس كمية الحرارة أو المسعر calorimeter في مقدمة هذه الأجهزة، وتسمى القياسات التي تجرى بوساطته القياسات المسعرية calorimetry. يبين الشكل-1- أحد الأنواع الذي يدعى مسعر برتوليه، ويستخدم لقياسات الحرارة الكتلية، ويلاحظ وجود عدد من الطبقات العازلة والمتدرجة في درجة الحرارة للإقلال من الضياع بالتوصيل وبالإشعاع، وهو مغلق لمنع الانتقال بالحمل، كما تفضض بعض السطوح لتخفيض الإشعاع أيضاً. ويبين الشكل-2- نوعا آخر يستعمل لقياس حرارة الاحتراق أو الحرارة الناتجة من التفاعلات الكيميائية، اتخذت فيه الاحتياطات لتحمل الضغوط العالية ،لذلك يسميه البعض القنبلة المسعرية.
تطورت القياسات بعدئذ وازدادت دقتها، فأمكن تخفيض كمية المادة المستعملة فأصبحت تسمى القياسات المسعرية الدقيقة microcalorimetry، أصبح بالإمكان إعطاء كمية من الحرارة وتتبع ما تحدثه من تغييرات في درجة الحرارة زمنياً، مما مَكَّن من اكتشاف التغيرات في أطوار المادة المدروسة أو في تركيبها الكيميائي. تدعى هذه الطريقة المسح الحراري (المسعري) التفاضلي diferential scanning calorimetry، كما أمكن، بإضافة عدد من موازين الحرارة في مناطق مختلفة من المادة قياس ناقليتها الحرارية في الوقت نفسه.
تفيد القياسات الحرارية ، إضافة إلى قياس الحرارة الكتلية ومنافعها وحرارة التفاعلات الكيميائية وحرارة الانصهار والتبخر، في موضوع التغذية والاستقلاب (الأيض) والتخمر وفي التبادلات الحرارية وسرعة انتقالها.
فوزي عوض
Heat and Thermal measurements - Chaleur et Mesures thermiques
الحرارة والقياسات الحرارية
ترتبط كمية الحرارة بدرجة الحرارة[ر] ارتباطاً وثيقاً، حتى إن بعضهم يستعمل كلمة «حرارة» لتدل على كليهما دلالة تفتقر إلى الدقة. فدرجة الحرارة temperature خاصة تساعد على تحديد حالة الجسم الحرارية، وهي مستمدة أولاً من الإحساس اللمسي، بينما كمية الحرارة أو الحرارة heat اختصاراً هي شكل من أشكال الطاقة وتقاس خلال انتقالها من جسم إلى آخر إذا كانت درجتا حرارتيهما مختلفتين.
وبصورة عامة، إذا أعطي جسم كمية من الحرارة ترتفع درجة حرارته، لكنه إذا وجدت المادة في طورين في حالة توازن عند درجة حرارة معينة قد لا يظهر تأثير كمية الحرارة على شكل تغير في درجة الحرارة وإنما سيظهر على شكل تغير في النسبة بين الطورين؛ مثل ما يحدث عندما يكون لدينا مزيج من الماء والجليد في الدرجة صفر مئوية تحت الضغط الجوي النظامي. إن تحديد حالة الجسم أو ما يعرف بصورة عامة بالجملة، يحتاج إضافة إلى تحديد درجة الحرارة تحديد قيم خواص أخرى، مثل الحجم أو الضغط أو النسبة في حالة المزيج، وهذا ما يتناوله علم التحريك الحراري[ر]. كان الكيميائي جوزيف بلاك Joseph Black عام 1770 أول من أشار بوضوح إلى ضرورة التمييز بين درجة الحرارة والحرارة. إذ كان لغزاً معرفة ما يحدث لدى وضع جسم حار على اتصال مع جسم أشد برودة منه، وخاصة السؤال عما ينتقل خلال هذه العملية. فوضعت نظرية الكالوري calory التي لم يبق منها إلا اسمها الذي أطلق على واحدة كمية الحرارة المعروفة بالاسم نفسه أو بالحريرة. لقد كان يعتقد، وفق هذه النظرية، بوجود سائل لا يرى يملأ كل شيء له وزن، مكون من جسيمات تتنافر فيما بينها وتتجاذب مع جسيمات المادة، وهو محفوظ. غير أن التجارب المختلفة والقياسات الدقيقة التي قام بها الكونت رمفورد ب. تومبسون B.Thompson، وجيمس جول[ر] J.Joule وسادي كارنو S.Carnot ربطت بين الحرارة المتولدة والعمل الميكانيكي المبذول، وكذلك مع الطاقة الكهربائية والطاقة الكيميائية، فتوصلوا إلى أن الحرارة ليست إلا شكلاً من أشكال الطاقة فأصبحت تقدر بالجول، كما عيّن المعادل الميكانيكي للحريرة. يعرف هذا التكافؤ الآن بالمبدأ الأول في الترموديناميك .
تتميز الطاقة الحرارية من الأشكال الأخرى، حين ينظر إلى حركة حاملاتها، بالعشوائية، لذلك فإن تحول الأشكال الأخرى إلى حرارة هو عملية سهلة تجري بصورة طبيعية ،مثل ظهورها عند الاحتكاك الميكانيكي أو عند مرور تيار كهربائي. غير أن تحويل الحرارة إلى الأشكال الأخرى عملية تحتاج إلى ترتيبات خاصة، وكان البحث عن أفضل المحركات الحرارية سبب ظهور علم التحريك الحراري. وقد أشار اللورد كلفن وهو و. تومبسون W.Thompson عام 1849 إلى تناقض نظرية الكالوري مع النتائج التجريبية، ثم أتى كلاوزيوس عام 1950 ليحل ما تبقى من تناقضات بإدخال مفهوم الأنتروبية[ر]، الذي يربط بين كمية الحرارة التي تتبادلها الجملة مع درجة الحرارة التي تم عندها التبادل على شكل نسبة بينهما، وقال إن هذه خاصة من خواص الجملة كطاقتها الداخلية.
القياسات الحرارية
يطلق اسم القياسات الحرارية على جميع القياسات التي تدخل فيها درجة الحرارة كمتحول، فهي تشمل مثلاً قياس الناقلية الحرارية والحرارة الكتلية[ر] والقوة المحركة الكهربائية في المزدوجة الكهرحرارية والإشعاع الحراري؛ إضافة إلى قياس حرارة الانصهار[ر] وحرارة التبخر وكميات الحرارة المرافقة لتغيرات الأطوار الأخرى مثل قياس كمية الحرارة المرافقة لتغير طور بعض المواد الصلبة المغنطيسية إلى طور لامغنطيسي، أو قياس كميات الحرارة الناتجة من التفاعلات الكيميائية.
 |
 |
|
| الشكل (1) مسعر برتوليه | الشكل (2) القنبلة المسعرية | |
تطورت القياسات بعدئذ وازدادت دقتها، فأمكن تخفيض كمية المادة المستعملة فأصبحت تسمى القياسات المسعرية الدقيقة microcalorimetry، أصبح بالإمكان إعطاء كمية من الحرارة وتتبع ما تحدثه من تغييرات في درجة الحرارة زمنياً، مما مَكَّن من اكتشاف التغيرات في أطوار المادة المدروسة أو في تركيبها الكيميائي. تدعى هذه الطريقة المسح الحراري (المسعري) التفاضلي diferential scanning calorimetry، كما أمكن، بإضافة عدد من موازين الحرارة في مناطق مختلفة من المادة قياس ناقليتها الحرارية في الوقت نفسه.
تفيد القياسات الحرارية ، إضافة إلى قياس الحرارة الكتلية ومنافعها وحرارة التفاعلات الكيميائية وحرارة الانصهار والتبخر، في موضوع التغذية والاستقلاب (الأيض) والتخمر وفي التبادلات الحرارية وسرعة انتقالها.
فوزي عوض
